Różnica między punktem końcowym a punktem równoważności
- 2599
- 634
- Krystyna Urbanowicz
Punkt końcowy i punkt równoważności to dwa najważniejsze pojęcia w miareczkach chemii. Technika miareczkowania może wystąpić w reakcjach redoks, reakcjach kwasowych i wielu innych reakcjach. Jest stosowany głównie w reakcjach kwasowo-zasadowych, w których obejmuje neutralizację innego roztworu z drugim w celu określenia nieznanego stężenia. Zasadniczo standardowy roztwór ze znanym stężeniem jest starannie wlewany do innego roztworu zwanego analitem o nieznanym stężeniu w celu obliczenia jego stężenia.
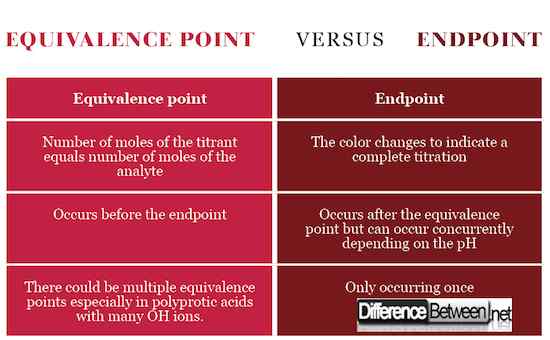
Podczas procesu miareczkowania są osiągnięte dwa etapy, a mianowicie. punkt końcowy i punkt równoważności. Punkt równoważności, zwany również punktem stechiometrycznym, w skrócie, jest punktem, w którym mole dwóch roztworów, kwas i zasada, są równoważne lub równe. Etap występuje przed punktem końcowym, który sygnalizuje zakończenie reakcji. W niektórych reakcjach może istnieć wiele punktów równoważności, szczególnie w kwasach poliprotycznych i zasadach, w których istnieje wiele jonów wodorotlenkowych.
Ten artykuł rozwija kluczową różnicę między punktem końcowym a punktem równoważności w miareczkowaniach chemicznych.

Definicja punktu równoważności
Punkt równoważności w miareczkowaniu kwasowo-zasadowej sygnalizuje zakończenie reakcji, w której liczba moli mianowitu i analitu jest równa jak w równaniu chemicznym. Na przykład w miareczkowaniu NaOH i HCl 1 mol HCl będzie równy dokładnie 1 kretowi NaOH w punkcie równoważności. Punkt ten należy dokładnie osiągnąć, podając szereg kropli standardowego roztworu do nieznanego stężenia. Pipeta jest zwykle używana do wlania kropli titrant do kolby pomiarowej, w której analit został wylany z określonym wskaźnikiem. Wskaźniki są ważne w miareczkach kwasowych, aby wyraźnie zobaczyć równoważność i punkty końcowe.
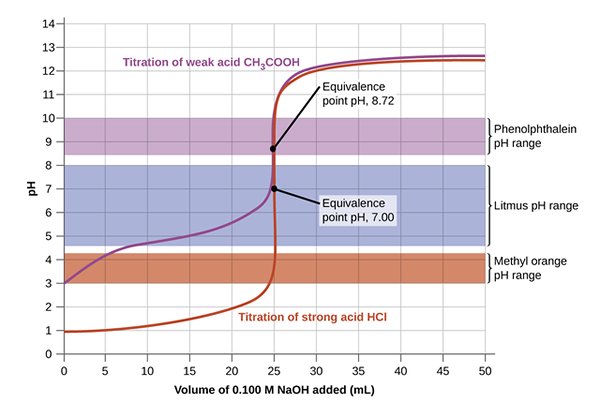
Miareczkowanie kwasu i zasady może wystąpić między silną zasadą i słabą zasadą; silny zasada i słaby kwas; silna podstawa i silna podstawa; lub słabe kwasy poliprotyczne. Można zastosować inny wskaźnik w zależności od typowego rozwiązania stosowanego do miareczkowania. Na przykład w miareczkach NaOH i HCL stosuje się fenoloftaleinę, podczas gdy w NH3 i HCL Wskaźnik pomarańczowy metylowy jest bardziej odpowiedni do wprowadzania zmian. Jeśli pH titrant odpowiada pH w punkcie równoważności, punkt końcowy i punkt równoważności może wystąpić jednocześnie.
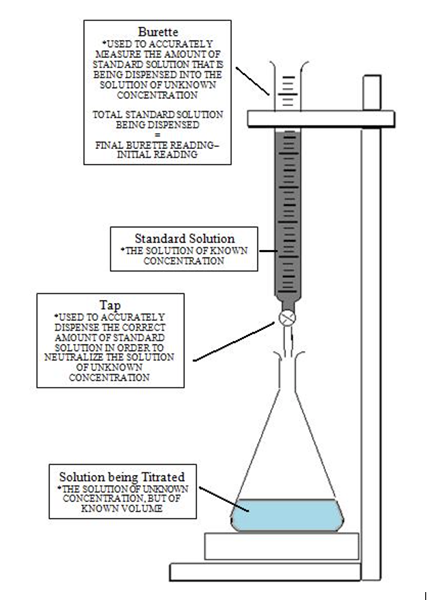
Poniższy obraz daje jasne zrozumienie miareczkowania ustawionego w celu osiągnięcia punktu równoważności, a następnie dotarcia do punktu końcowego, gdy zmienia się kolor. Początkowo roztwór z nieznanym stężeniem jest wylewa się wskaźnikiem. Następnie dodaje się titrant za pomocą biurety poprzez kontrolowanie kropli z zaworem. Równanie mkwasVkwas = MbazaVbaza stosuje się do obliczenia nieznanego stężenia za pomocą manipulacji algebraicznych, zauważając, że molowość to liczba moli na litr.
Definicja punktu końcowego
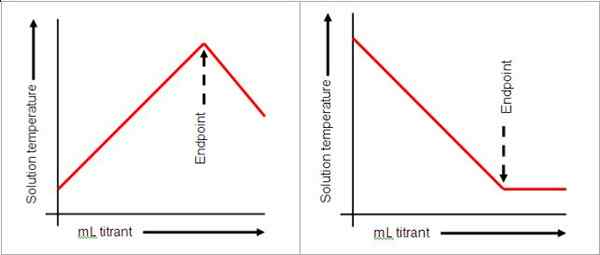
Punkt końcowy pojawia się po punkcie równoważności w miareczkach. Wskazuje, że punkt równoważności został osiągnięty. Ten punkt końcowy jest wskazywany przez zmianę koloru roztworu. Zobacz zdjęcie poniżej:

Zdjęcie dzięki uprzejmości: Chemistry Libretexts
Aby dotrzeć do punktu końcowego, należy dokładnie podać ilość kropli, ponieważ pojedynczy kropla może zmienić pH roztworu. W sytuacji, w której punkt końcowy został przekazany, może być wykonane miareczkowanie wsteczne lub odwrotne miareczkowanie w zależności od charakteru rozwiązania. Jeśli wylano zbyt wiele titrant, punkt końcowy może zostać przekazany. Rozwiązaniem będzie dodanie kolejnego rozwiązania innego reagenta w nadmiarze.
Wskaźniki nie zawsze są używane w miareczkach. Mierniki pH można użyć do odczytania pH jako wskazania, że reakcja jest kompletna. W silnej zasadzie i kwasu pH 7 wskazuje, że reakcja jest kompletna. Zmiana koloru jest jednak wygodnym sposobem monitorowania punktu końcowego, dlatego często używane są wskaźniki. Roztwór końcowy chlorku sodu i kwasu sodowego, na co wskazuje fenoloftaleina, gdy roztwór zmienia różowy. Punkt końcowy niekoniecznie wskazuje koniec reakcji, ale zakończenie miareczkowania.
Różnica między punktem końcowym a równoważnością
Definicja punktu końcowego i równoważność
Punkt końcowy jest etapem miareczkowania, który jest wskazany przez zmianę koloru jako znak, że miareczkowanie jest zakończone i osiągnięto punkt równoważności. Z drugiej strony punkt równoważności jest etapem tuż przed punktem końcowym, który sygnalizuje punkt stechiometryczny z równą liczbą moli między analitem a titrantem zgodnie z równaniem chemicznym. Aby dotrzeć do punktu równoważności, titrant należy wylać dokładnie i precyzyjnie upuścić, upuszczając za pomocą biurety.
Występowanie punktu końcowego i równoważność
Punkt równoważności występuje, gdy liczba moli titranta, standardowe roztwór, jest równa liczbie moli analitu, roztwór o nieznanym stężeniu. Punkt końcowy występuje, gdy zmienia się kolor.
Znaczenie punktu końcowego i równoważność
Punkt równoważności oznacza, że titrant w pełni zareagował z analitem, podczas gdy punkt końcowy sygnalizuje zakończenie miareczkowania. Punkt końcowy i równoważność mogą wystąpić w tym samym czasie, jeśli pH titrant odpowiada pH w punkcie równoważności.
Endinpoint Verses Equivenlence: Mapa porównawcza
Podsumowanie równoważności wersetów punktu końcowego
- Punkt końcowy i punkt równoważności są najważniejszymi etapami miareczkowania chemicznego
- Punkt końcowy ma miejsce po punkcie równoważności i wskazuje na zakończenie miareczkowania, ale nie zawsze koniec reakcji.
- Punkt równoważności występuje przed punktem końcowym i wskazuje pełną reakcję między titrantem a analitem, w którym liczba moli titrant jest równa liczbie moli nieznanego stężenia
- Punkt końcowy jest osiągany, gdy kolor zmienia się, jeśli wskaźnik został użyty
- Inne słabe kwasy mogą mieć wiele punktów równoważności, ale tylko jeden punkt końcowy
- Punkt równoważności jest również nazywany punktem stechiometrycznym

