Różnica między atomem a molem
- 5002
- 147
- Salwator Słowiński
Materia to wszystko, co zajmuje przestrzeń i ma masę. W rzeczywistości wszystko wokół nas jest wykonane z materii, w tym powietrze, które oddychamy, rzeczy, które możemy dotknąć lub wąchać, lub przedmioty, z którymi codziennie mamy do czynienia. Jedną z podstawowych właściwości materii jest jej skład lub określone typy atomów i cząsteczek, które to tworzą. Atomy są najmniejszą niewidzialną jednostką elementu. Są zbyt małe, aby zobaczyć mikroskop. Do XX wieku naukowcy nie mieli solidnych dowodów dotyczących istnienia atomów. Dopiero kilku greckich filozofów natknęło się na pogląd, że materia może się składać z atomów, naukowcy zaczęli rozumieć koncepcję atomów.
Cząsteczki są zbieraniem atomów, które są utrzymywane razem przez wiązania chemiczne, reprezentujące najmniejszą podstawową jednostkę związku chemicznego o właściwościach chemicznych tego związku. Jednak atomy i cząsteczki są zbyt małe, aby były wygodne w przypadku bardziej praktycznych zastosowań. Jednostką używaną do zdefiniowania ilości substancji w reakcji chemicznej jest „kret”. Mole to jednostka ilościowa w chemii, która zawiera tyle cząstek, ile jest atomy w dokładnie 12 gramach węgla-12. Most między atomami i moli to numer Avogadro, 6.022 × 1023.

Co to jest atom?
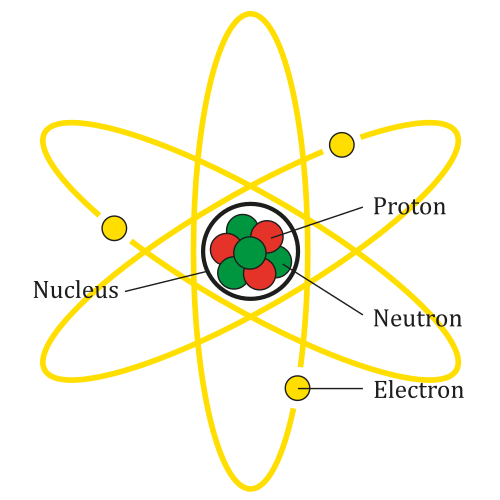
Atom jest najmniejszą jednostką elementu. Atomy są zbyt małe, aby były widoczne dla nagiego oka lub zobaczyć mikroskop. Rzadko istnieją jako pojedyncze jednostki; W rzeczywistości łączą się ze sobą, aby produkować znane przedmioty codziennego życia. Pierwszą osobą, która zaproponowała istnienie atomów, był grecki filozof Leucippus, a tym samym rozwinął teorię atomizmu. Jego uczeń, Demokryt, przyczynił się do teorii atomizmu, sugerując, że materia jest w rzeczywistości wykonana z niewielkich niezniszczalnych cząstek zwanych „atomos”, co oznacza nieokreślone, co stanowiło pochodzenie słowa Atom Atom. I dopiero w XX wieku ujawniono wewnętrzną strukturę atomu. Atomy składają się z określonej kombinacji trzech rodzajów cząstek subatomowych: protonów, neutronów i elektronów.
Co to jest kret?
Mole jest jednostką ilości, która zawiera tyle cząstek, ile jest atomy w dokładnie 12 gramach węgla-12. Teoria atomowa Johna Daltona położyła fundamenty współczesnej chemii. Sformułował pierwszą teorię atomową na początku XIX wieku, zbierając i analizując dane naukowe od swoich rówieśników. To był świetny przykład tego, jak stosuje się metodę. Teoria związała się z nią kilka postulatów. Jednak jednym problemem z jego teorią w tym czasie było to, że ilość materii można było zmierzyć tylko w kategoriach masowych. Nie było sposobu, aby lepiej zrozumieć ilość materii na poziomie atomowym. Jednostką używaną do zdefiniowania ilości substancji w reakcji chemicznej jest „kret”. Ta jednostka jest zarezerwowana dla bardzo małych części, takich jak atomy lub cząsteczki.
Różnica między atomami i moli
Definicja atomów vs. Mole
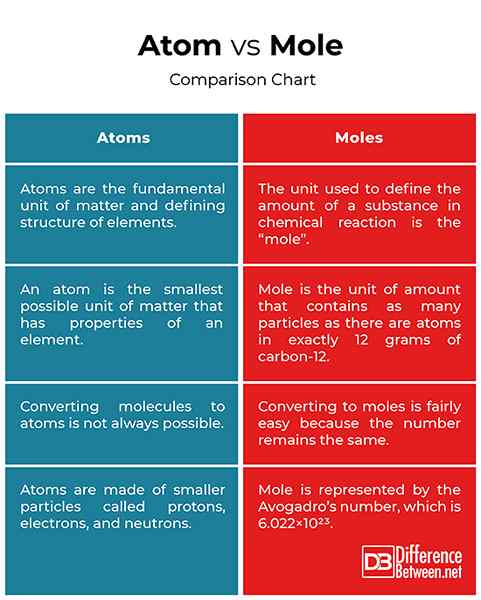
- Atomy są podstawową jednostką materii i definiującą strukturę elementów. Atom jest najmniejszą możliwą jednostką materii, która ma właściwości elementu. Atomy to małe struktury, które są wiele tysięcy razy za małe, aby zobaczyć mikroskop, nie mówiąc już o gołym oku. Mole to jednostka ilościowa w chemii, która zawiera tyle cząstek, ile jest atomy w dokładnie 12 gramach węgla-12. Kret jest jednostką używaną do zdefiniowania ilości substancji w reakcji chemicznej.
Konwersja atomów i moli
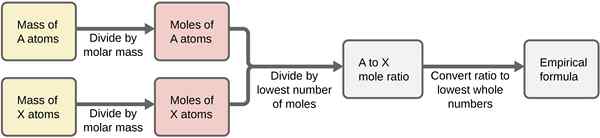
- Niektóre cząsteczki są wykonane z więcej niż jednego rodzaju atomów, więc przekształcenie ich w atomy nie zawsze jest możliwe. Na przykład co2 ma dwa atomy tlenu i jeden atom węgla, co stanowi łącznie trzy atomy w jednej cząsteczce. Tak więc dla dwóch cząsteczek Co2, Masz dwa atomy węgla i cztery atomy tlenu. Mol jest zarezerwowany do pomiaru małych jednostek, takich jak atomy lub cząsteczki. Jeden kret to liczba cząstek Avogadro, która wynosi 6.022 × 1023. Tak więc nawrócenie na mole jest stosunkowo łatwe, ponieważ liczba pozostaje taka sama.
Struktura atomów i moli
- Atomy są wykonane z mniejszych cząstek zwanych protonami, elektronami i neutronami. Atomy są tak małe, że nie można ich zobaczyć nagim okiem. Można je zobaczyć tylko za pomocą specjalnych mikroskopów o dużej mocy używanych przez naukowców. Jądro jest centrum atomu, który zawiera jeden lub więcej protonów (dodatnio naładowanych) i neutronów (bez ładunku). Z drugiej strony kret jest specjalną jednostką, która opisuje duży zbiór atomów lub cząsteczek. Mole jest reprezentowane przez numer Avogadro (6.022 × 1023). Jeden kret dowolnej substancji zawiera liczbę jednostek tej substancji Avogadro, ale masa zmienia się w zależności od obiektu.
Atom vs. Mole: wykres porównawczy
Podsumowanie atomów vs. Mole
Krótko mówiąc, most między atomami i moli to liczba Avogadro, która wynosi 6.022 × 1023. Liczba Avogadro jest podstawą mola, ponieważ sprawia, że obliczanie masy lub masy jednego mola jest dość łatwe. Mol jest zarezerwowany do pomiaru małych jednostek, takich jak atomy lub cząsteczki. Z drugiej strony atomy są najmniejszą niewidzialną jednostką elementu, które są zbyt małe, aby zobaczyć mikroskop. Atomy składają się z określonej kombinacji trzech rodzajów cząstek subatomowych: protonów, neutronów i elektronów. Kret jest zwykle reprezentowany przez numer Avogadro.

