Różnica między amyloidem a prionem
- 2416
- 519
- Krystyna Urbanowicz

Amyloidy i prions są synonimem zaburzeń neurodegeneracyjnych, zaburzeń, które powodują zwyrodnienie w mózgu. Amyloidy nie są specyficzne dla mózgu, ponieważ mogą powodować zaburzenia w jakichkolwiek narządach w ciele. Jeśli chodzi o neurologię, ludzkie zaburzenia neurodegeneracyjne, za które amyloidy i prions są bezpośrednio lub pośrednio odpowiedzialne, to te takie jak choroba choroby Alzheimera, choroba Parkinsona i choroba Creutzfeldt-Jakob choroby. Zrozumienie działania w amyloidach stanowi ważny aspekt zrozumienia prionów i neurodegeneracji.
Różnica między amyloidem a prionem
Definicja i patofizjologia
Amyloidy są agregatami (formacja wykonana z wielu części zebranych razem) struktury przypominającej pręty, która zawiera powtórzenia pewnego rodzaju białka. Kiedy nieprawidłowe komórki osocza wynikające z szpiku kostnego tworzą nieprawidłowe białka lekkiego łańcucha, wchodzą do krwioobiegu i tworzą złogi amyloidowe. Złoża te mogą powodować gromadzenie się na dowolnym narządach istotnych w ciele (takich jak mózg, serce lub jelita), co powoduje różne poważne schorzenia.
Prony są nieprawidłową postacią lub fałdowaniem specyficznych białek amyloidów osadzonych w mózgu, czyniąc je zaraźliwymi i zdolnymi do przedłużania się na czas nieokreślony. Innymi słowy, prions są zdefiniowane jako podklasa amyloidów, w których agregacja białka była zakaźna i zmieniła stan samozadowolenia. PRIONY mają zdolność przekazywania nieprawidłowo sfałdowanego kształtu białka na te same białka występujące w stanie normalnym.
PRIONY są odpowiedzialne za zaburzenia neurodegeneracyjne, które mogą wystąpić u ludzi i zwierząt. Wynika to z tego, że błyszczone białko jest trudniejsze do rozbicia przez enzymy i zamiast tego gromadzi się w neuronach, co powoduje zniszczenie. Kiedy to niszczenie neuronu, stopniowo powoduje, że tkanka mózgu ma wzór podobny do gąbki wypełniony otworami.
Potencjalne przyczyny
Amyloidy występują, gdy szpik kostny wytwarza nieprawidłowe komórki osocza krwi. Te nieprawidłowe komórki osocza tworzą się następnie nienormalne typy białek łańcucha lekkiego. Kiedy nieprawidłowe białka lekkiego łańcucha wchodzą do układu krążenia (krwioodporne), składają się na istotne narządy w całym ciele. Może to wynikać z:
- Składniki genetyczne lub dziedziczne (które wpływają na oczy, serce, nerki i mózg)
- Przewlekłe choroby i rodzaje nowotworów
- Mutacje komórkowe
- Rzadkie infekcje
Prions to błyszczone białka powodujące amyloidy osadzone w mózgu. Genetycznie gen PRNP jest odpowiedzialny za kierowanie organizmem do białka prionowego produktu. Kiedy ten gen mutuje się, może powodować nieprawidłowe wytwarzanie białka, co powoduje specyficzne choroby prionowe mózgu. Choroba prionowa może również wystąpić sporadycznie, powodując inne specyficzne choroby mózgu.
Objawy
Objawy nieprawidłowych złóż białka amyloidowego różnią.
Choroba prionowa, spowodowana przez błyszczone białka prionowe powodujące amyloidy w mózgu, często przedstawia następujące objawy:
- Trudności i zmiany w osądu
- Zmiany osobowości
- Zamieszanie, trudność z mową i/lub dezorientacją
- Zmiany w koordynacji i mimowolnych skurczach mięśni
- Zmniejszona jakość widzenia lub ślepoty
Diagnoza
Diagnozowanie występowania amyloidów w narządach dotkniętych. Obejmują one pomiar zmian wielkości narządu i jego funkcji, mierzenie poziomów określonych białek we krwi, w płynie mózgowo -rdzeniowym i na skanach (MRI, CT, PET).
Diagnozowanie białek prionowych w mózgu powodującym chorobę prionową można wykonać poprzez skany mózgu w celu pomiaru funkcji i wielkości, badanie płynu mózgowo -rdzeniowego dla specyficznych markerów choroby prionowej i markerów neurodegeneracji oraz EEG w celu rejestrowania zmian aktywności elektrycznej w mózgu w mózgu.
Leczenie
Leczenie amyloidów zależy od tego, gdzie się pojawią. Jedynym sposobem na całkowite zniesienie amyloidów z wytwarzania jest przejście intensywnej chemioterapii w celu zniszczenia nieprawidłowych komórek krwi w szpiku kostnym odpowiedzialnym za produkcję amyloidu. Nie ma innego sposobu leczenia amyloidów, a zaburzenia spowodowane ich wystąpieniem są traktowane konkretnie.
Prionki powodujące chorobę prionową można leczyć lekami, życie wspomagane związane z neurodegeneracją, podtrzymywaniem nawodnienia i spożyciem składników odżywczych. Nie leczy to produkcji prionów lub neurodegeneracji, ale stanowi sposób na poprawę jakości życia i leczenia związanych z nimi objawów.
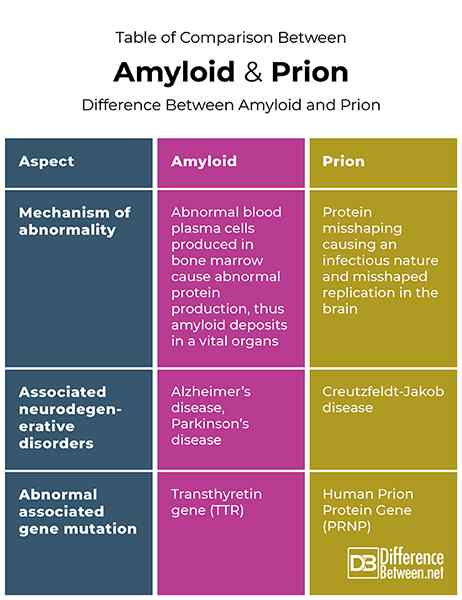
Tabela porównania między amyloidem i prionem
Podsumowanie amyloidu vs prion
Amyloidy i prions są związane z zniekształceniem białka i niektórymi zaburzeniami neurodegeneracyjnymi. W przypadku amyloidów błyszczone białka mogą powodować zaburzenia w dowolnym narządie, w którym są osadzone. PRIONY są jednak błyszczonymi białkami, które mogą powodować amyloidy w mózgu i mają powiązane zaburzenia ograniczone do mózgu. Jeśli chodzi o zaburzenia neurodegeneracyjne, amyloidy są odpowiedzialne za chorobę Alzheimera i chorobę Parkinsona, gdzie prions są odpowiedzialne za chorobę Creutzfeldt-Jakob.
FAQ
Są prionami typem amyloidu?
Amyloidy są agregatami o strukturze fibrylarnej, która składa się z powtórzeń specyficznego białka. Prony są zdefiniowane jako pod klasa amyloidów. W przypadku prionów agregacja białek staje się samowystarczalna, a następnie staje się zakaźna-jest to przyczyna wielu śmiertelnych chorób neurodegeneracyjnych, takich jak Creutzfeldt-Jacob Choroba.
W jaki sposób płytki amyloidowe są powiązane z prionami?
Płytki amyloidowe znaleziono w mózgach osób z chorobą Creutzfeldt-Jacob. Choroba Creutzfeldt-Jacob jest chorobą spowodowaną przez prion. Scrapie to kolejna choroba prionowa, tym razem stwierdzona u zwierząt, z płytkami amyloidowymi, które składają się z białek prionowych
Jaka jest różnica między prionem a białkiem?
Główna różnica między białkiem a prionem jest w strukturze - proc są nieprawidłowe, powodując, że są w stanie zmienić kształt innych podobnych białek, stając się w ten sposób zakaźne.
Czy amyloidowa beta jest prion?
Ze względu na zdolność do samowystarczalności, a także istnienie kilku odrębnych „szczepów”, beta amyloidowe ma wiele nierozróżnialnych właściwości z prionami. Te właściwości są prawdopodobnie umożliwiające stać się prionem podczas chorób.
- « Różnica między zespołem jelita drażliwego a nietolerancją laktozy
- Różnica między siłą elektromotoryczną a siłą magnetomotywową »

