Różnica między Sigma i Pi Bond
- 1309
- 285
- Maksym Cieślik
Co to jest Sigma Bond?
Wiązania sigma są wiązaniami między atomami w cząsteczkach utworzonych wzdłuż osi łączącej związane jądra atomów.
Wiązania molekularne
Cząsteczki powstają, gdy atomy wymieniają lub dzielą elektrony poprzez wiązanie chemiczne. Istnieją zasadniczo trzy rodzaje obligacji. Obligacje jonowe, wiązania metaliczne i wiązania kowalencyjne. W wiązaniach jonowych atomy po prostu wymienią elektron, aby jeden atom został dodatnio naładowany, a drugi ujemnie naładowany, powodując, że przyciągają je siła elektromagnetyczna. W wiązaniach metalicznych elektrony będą równomiernie rozmieszczone przez całą cząsteczkę, tworząc morze wolnych, delokalizowanych elektronów otaczających dodatnio naładowane jony przyciągane do elektronów.
W obrębie wiązań kowalencyjnych elektrony są dzielone, a sposób, w jaki są one dzielone, jest chmury prawdopodobieństwa elektronów i orbitali, w których się znajdują, nakładają się w sposób, który jest w przybliżeniu symetryczny.
Orbitale i obligacje sigma
Orbitale to regiony wokół atomów związanych z pewnymi poziomami energii. Elektrony w orbitalach dalej od jądra będą miały więcej energii niż elektrony w orbitalach bliżej jądra. Gdy orbitale jednego atomu pokrywają się z orbitaliami z innego atomu, tworzą one orbitale molekularne, które pozwalają na wiązania molekularne, które oczywiście pozwalają na cząsteczki.
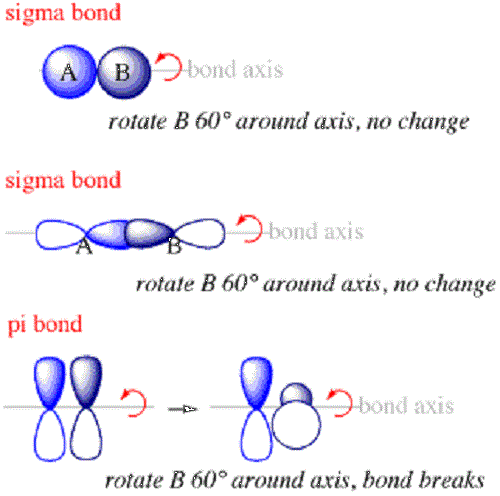
Wiązania sigma są pierwszym rodzajem wiązania, które powstanie między atomami. W obrębie wiązania sigma chmury prawdopodobieństwa elektronu będą wzdłuż osi łączącej jądra związanych atomów. Obligacje sigma zwykle tworzą się, kiedy S orbitale z różnych atomów pokrywają się, aby stworzyć wiązanie. Zawsze będą tworzyć się wzdłuż osi między dwoma jąderami, ponieważ S Orbital jest ułożony w coś w rodzaju kuli wokół jądra.
Obligacje Sigma i orbitale Sigma
Elektrony tworzące wiązanie sigma będą znajdować się w orbitalach Sigma, a zatem znajdą się gdzieś wzdłuż osi łączącej jądra związanych atomów. Wiązanie sigma może jednak być stabilne lub niestabilne w zależności od tego, czy elektrony znajdują się na orbitalach wiązania sigma, czy w orbitalach przeciw wiązaniu.
Orbitale wiązania sigma będą znajdować się w przestrzeni między jąderkami, podczas gdy orbitale przeciw wiązaniu będą wzdłuż osi łączące jądra, ale po bokach atomów naprzeciwko przestrzeni między nimi. Wiązanie sigma będzie stabilne, jeśli więcej elektronów znajduje się na orbitalach wiązania i niestabilne, jeśli więcej znajduje się na orbitalach przeciwbólowych lub jeśli istnieje równa liczba elektronów w obu.

Co to jest Pi Bond?
Wiązania PI są wiązaniami między atomami w cząsteczkach, w których elektrony znajdują się powyżej i poniżej osi łączącej jądra połączonych atomów, ale nie wzdłuż osi. Są drugim rodzajem wiązania, które powstanie w cząsteczce po wiązaniu sigma.
Obligacje PI i P orbitale
Powodem, dla którego wiązania Pi tworzą się powyżej i poniżej osi wiązania, ale nie jest to, ponieważ tworzą się zwykle z nakładających się orbitali, takich jak P orbitale na związanych atomach. Te orbitale nie mają gęstości elektronów w jądrze. W rezultacie elektrony tworzą wiązania PI, które powstają z nakładania się P orbitale zawsze będą skupiać się w obszarze, który nie jest bezpośrednio przylegający do jądra. Obligacje PI mogą również tworzyć się między innymi orbitalami atomowymi, takimi jak D orbitale, które mają wspólne cechy P orbitale.
Obligacje PI i orbitale PI
Gdy P Orbitale o różnych atomach nakładają się, tworzą molekularne orbitale PI, które pozwalają na tworzenie wiązań PI. Wiązanie może ponownie być stabilne lub niestabilne w zależności od orbity, na której znajduje się elektron. Wiązanie PI będzie stabilne, jeśli więcej elektronów znajduje się w orbitalach wiązania PI. Będzie niestabilny, jeśli więcej znajduje się na orbitalach przeciwblwowych lub jeśli równa liczba jest w obu.
Podobieństwa między wiązaniami sigma i wiązaniami PI
Wiązania sigma i wiązania PI są oparte na specyficznych orbitalach molekularnych, które pochodzą z nakładania się poszczególnych orbitali atomowych, na przykład, S orbitale w przypadku obligacji sigma i P orbitale w przypadku obligacji PI. Mogą być również stabilne lub niestabilne w zależności od tego, czy elektrony znajdują się w orbitalach molekularnych wiążących lub orbitali cząsteczkowych.
Różnice między wiązaniami sigma i wiązaniami PI
Pomimo ich podobieństw istnieją ważne różnice.
- Elektrony tworzące wiązania sigma będą rozmieszczone w przestrzeni wzdłuż osi łączącej połączone jądra, podczas gdy elektrony w obrębie PI będą rozmieszczone powyżej i poniżej osi, ale nie wzdłuż niej.
- Wiązania sigma są pierwszymi wiązaniami, które powstają między atomami w cząsteczkach, podczas gdy wiązania PI są drugie.
- Wiązania sigma są często tworzone przez kombinację S orbitale w różnych atomach, podczas gdy wiązania PI powstają z kombinacji P i podobne orbitale w różnych atomach.
- Ponadto orientacja nakładających się orbitali, które tworzą wiązania PI, będzie prostopadłe do orbitali nakładających się.
Obligacje Sigma vs. Obligacje pi
| Sigma Bond | Pi Bond |
| Orbitale atomowe pokrywają się wzdłuż osi wiązania | Orbitale atomowe nakładają się powyżej i poniżej osi wiązania |
| Pierwsze wiązania w tworzeniu atomów w cząsteczkach | Drugie wiązania z tworzeniem się między atomami w cząsteczkach |
| Utworzone z nakładających się orbitali, takich jak S orbitale | Utworzone z nakładających się orbitali, takich jak P orbitale |
| Nakładające się orbitale prostopadłe do wiązań PI | Nakładające się orbitale prostopadłe do wiązań sigma |
Podsumowanie: Obligacje Sigma i Pi
Wiązanie sigma jest wiązaniem między atomami w cząsteczce, która jest często tworzona przez S orbitale nakładające się na oś łączące połączone jądra. Jest to pierwsza utworzenie, a jego stabilność zależy od tego, w jaki sposób elektrony są rozmieszczone w orbitalach wiązania sigma i antybondacji. Wiązania PI są wiązaniami molekularnymi tworzonymi często z nakładania się P orbitale z różnych atomów. Elektrony tworzące wiązania PI będą rozmieszczone powyżej i poniżej osi łączącej jądra związanych atomów, ale nie wzdłuż osi. Stabilność tych wiązań zależy również od wiązania i przeciwbodzącego się orbitali PI. Wiązania sigma będą pierwszymi wiązaniami, które utworzą się w cząsteczkach, podczas gdy wiązania PI będą drugim wiązaniami, które tworzą. Wiązania PI powstają również z orbitali atomowych, które są zorientowane prostopadle do tych, które tworzą wiązania sigma.

