Różnica między okresami i grupami
- 4527
- 1103
- Emilia Rudziński
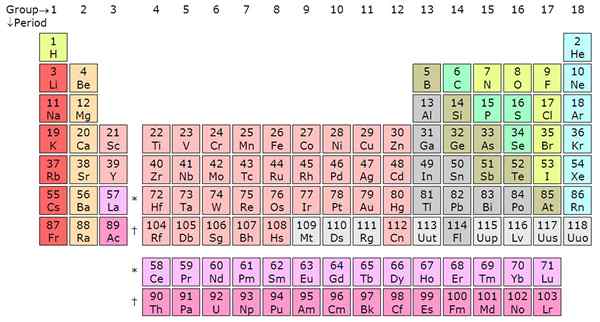
Okresy i grupy to dwie ważne klasyfikacje, których starożytni chemicy używali do zorganizowania kultowej okresowej tabeli w kolumnach i rzędach. Okresy są rzędami poziomymi, podczas gdy grupy, zwane również rodziny, są pionowymi kolumnami. Elementy zostały ułożone w grupy i okresy oparte na pewnych cechach, takich jak właściwości chemiczne/fizyczne dla grup i konfiguracji elektronów dla okresów. Artykuł rozwija dalsze różnice między okresami i grupami.

Jakie są okresy?
Licząc od lewej do skrajnej prawej w stoliku okresowym, jest to okres. Zazwyczaj są 7 okresów w stole okresowym, a każdy okres oznacza nową powłokę energii. Od wodoru do Francium w okresie 7, pierwiastki rosną w orbitalach atomowych. Oznacza to, że elektrony elementu będą reprezentowane na określonej liczbie poziomów energii zgodnie z etykietą okresową.
Na przykład lit (li) ma dwie skorupy energii, ponieważ jest w okresie 2, podczas gdy potas (k) ma cztery skorupy energii, ponieważ jest w okresie 4. Ten trend dotyczy wszystkich innych elementów. W okresie, elementy mają elektrony zewnętrzne (walencyjność). Na przykład wodór i hel są w tej samej grupie i mają jeden elektron w zewnętrznej skorupce. Zauważ, że pierwszy okres ma tylko dwa elementy. Drugi i trzeci okres mają 8 elementów.
Okresy 4 i 5 mają 18 elementów. Tabela okresowa ma łącznie 18 grup zgodnie z systemem nazewnictwa IUPAC. Okresy 6 i 7 są wyjątkami, ponieważ zawierają łącznie 32 elementy. Wyjaśnia to, dlaczego okresowa tabela jest skrócona poprzez usunięcie części okresu 6 i 7 i wyświetlanie tuż pod okresem okresowym. Okresowe byłyby duże, gdyby aktynidy i lantanowce nie zostały usunięte. Te oddzielone elementy to wewnętrzne metale przejściowe i wypełniają blok F w orbitalach atomowych. Lantanowce zawierają elementy od 58 do 71, podczas gdy aktynki zawierają elementy od 89 do 103.
Inną cechą, że elementy w danym okresie jest wzrost energii jonizacji. Atomy w okresie wzrostu liczby atomowej, ponieważ coraz częściej dodaje się więcej protonów. Zwiększa to przyciąganie w jądrze i będzie stosunkowo trudno usunąć elektron. Wzrost ładunku jądrowego w stole okresowej. Również elektrocjalizalność wzrasta, gdy przechodzisz od lewej do prawej w ciągu okresu. Powinowactwo elektronowe również wzrasta, gdy dodaje się więcej elektronów.
Jakie są grupy?
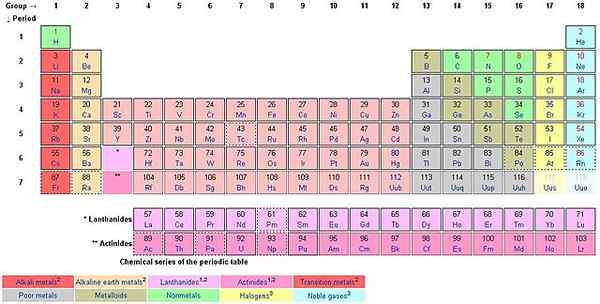
Gdy odliczasz od góry do dołu wzdłuż kolumn, liczysz grupy. Europejski styl nazewnictwa ꟷ Przyjęty jako styl nazewnictwa IUPAC, służy do nazwie grup od 1 do 18. Styl USA używa jako BS.
Każda z 18 grup ma imię. Na przykład pierwsza grupa znana jest jako rodzina litowa (alkaliczne metale), grupa 2 Berylum Family (Alkalin Earth Metals, grupa 3 The Scandium Family, grupa 4 Titanium Family, grupa 5 Rodzina Vanadium, grupa 6 The Chromium Family Family , grupa 7 The Manganese Family, grupa 8 Iron Family, grupa 9 The Cobalt Family, Grupa 10 Nickel Family, Grupa 11 The Copper Family (Monetage Meals), grupa 12 The Cynk Family (Volatile Meals), grupa 13 The Boron Family Family (ICOASAGENS), grupa 14 Rodzina węgla (Crystallogens, Tetrels), grupa 15 Rodzina azotu (Pentele), grupa 16 Rodzina tlenu (Chalcogens), grupa 17 Fluorowa rodzina (halogeny) oraz grupa 18 The Helium lub Neon Family (rodzina neonowa ( Gazy szlachetne).
Elementy w grupie mają właściwości chemiczne lub fizyczne. Na przykład grupa 18 nazywana jest gazami szlachetnymi. Nie są reaktywne z jakymi innymi elementami. Reguła o powierzchni 8 elektronów w zewnętrznej skorupce doskonale stosuje się do gazów szlachetnych. Wszystkie pozostałe elementy dążą do osiągnięcia zasady oktetu. Wodór nie podąża za zasadą oktetu, podobnie jak hel, chociaż jest stabilny i część gazów szlachetnych.
Tabela okresowa ma mieszankę metali, niemetalów i metaloidów (semimetale). Istnieją pewne elementy grupowania zgodnie z ich podobnymi właściwościami, w tym one metale alkaliczne, metale ziemi alkaliczne, metale przejściowe (lantandy, metale ziem rzadkich i aktynidy), niemetali, metaloidy, gazy szlachetne, halogeny i metale podstawowe.
Istnieje również trend rosnących nieruchomości, gdy ty w dół lub w górę grupy. Gdy wchodzisz, elektronowa powinowactwo 9electron) wzrasta właściwość. Kiedy schodzisz z grupy, powłoki energii wzrastają, a zatem przyciąganie jądra zmniejsza się, a zatem spada powinowactwo elektronowe w miarę upływu. Electronegative zmniejsza się również wraz z upływem grupy z powodu wzrostu poziomu energii w dół grupy. Elektrony w zewnętrznej skorupce są dalekie od jądra, a zatem pula zmniejsza się.
Kluczowe różnice między okresami i grupami
Lokalizacja w stole okresowym
Okresy są rzędami poziomymi, podczas gdy grupy są pionowymi kolumnami w tabeli okresowej. Istnieje 7 okresów i 18 grup. Okres 6 i 7 mają 32 elementy z powodu dodania aktyndów i lantanowców.
Określenie charakterystyk
Elementy w grupie mają podobne właściwości chemiczne lub fizyczne. Mają taką samą liczbę elektronów walencyjnych. Z drugiej strony elementy w tym samym okresie mają tę samą konfigurację elektronów.
Elektronialiczność
Elektonegatywne zmniejsza się w miarę upływu grupy i wzrośnie wraz ze wzrostem w górę z powodu zwiększonego przyciągania jądra w wyniku mniejszej liczby poziomów energii. Elektroniagatyczność wzrasta w miarę przechodzenia od lewej do prawej przez okres z dodaniem większej liczby protonów w miarę wzrostu liczb atomowych.
Okresy vs. Grupy: forma tabelaryczna

Podsumowanie okresów vs. Grupy
- Tabela okresowa jest ułożona w okresy i grupy
- Grupy są pionowymi kolumnami, a okresy są rzędami poziomymi
- Elementy w grupie mają właściwości chemiczne lub fizyczne, podczas gdy elementy w okresie mają takie same konfiguracje elektronów
- Istnieje 7 okresów i 18 grup na stole okresowym
- Elektroniarzowość wzrasta od lewej do prawej w ciągu okresu i od dołu do góry w grupie

