Różnica między ciśnieniem częściowym a ciśnieniem pary
- 722
- 138
- Marta Ruciński
Częściowe ciśnienie i ciśnienie pary są powszechnie stosowane naukowe terminy związane z ilością ciśnienia wywieranego przez komponenty systemowe, ale ich tożsamość może być myląca dla innych. Istnieje wyraźne rozróżnienie między tymi terminami, w tym ich skutki i tożsamość. Ten artykuł będzie bardziej szczegółowy na temat różnic między niniejszymi Warunkami. Obejmie również kilka przykładów, aby zdemistyfikować ich wnioski.
Zacznijmy od podkreślenia pojęcia presji, zanim będziemy mogli zagłębić się w rozróżnienie między pary i ciśnieniem częściowym. Ciśnienie jest naukowo definiowane jako siła przyłożona na jednostkę powierzchni na obiekt lub substancję. Można go również zdefiniować jako siłę przyłożoną przez cząstki zderzające się na siebie i jest często mierzone za pomocą Pascal. W przypadku zderzenia cząstek równanie gazu i kinetyczna teoria gazów stosuje się do obliczenia ciśnienia.

Co to jest ciśnienie pary?
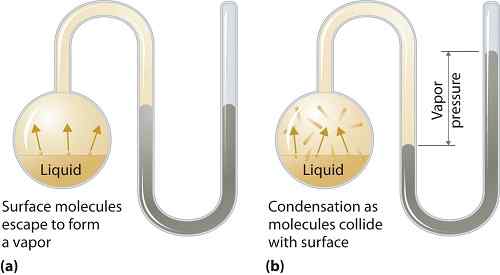
Ciśnienie pary może mieć zastosowanie do faz cieczy lub stałych. Jest to ciśnienie wywierane przez parę w jej równowagi termodynamicznej na jej cieczy lub stałym w danej temperaturze w układzie zamkniętym, gdy zarówno para, jak i ciecz (ciało stałe) są w kontakcie. Ciśnienie powstaje w wyniku waporyzacji, która jest włączona przez zwiększone ciepło na stałym lub cieczy. Zatem temperatura jest stosowana jako miara waporyzacji i jest ona bezpośrednio proporcjonalna do ciśnienia pary. Oznacza to, że im wyższa temperatura, tym wyższe ciśnienie pary.
Podczas parowania cząsteczki powietrza uciekają w wyniku wyższej energii kinetycznej do powietrza w zamkniętym systemie. Następnie w równowadze ciśnienie pary powstaje między oparą a jej skondensowaną postacią cieczy (stałą). W roztworach, w których siły międzycząsteczkowe są słabsze, ciśnienie pary jest zwykle bardziej, a odwrotnie, w roztworach, w których siły międzycząsteczkowe są silniejsze, ciśnienie pary jest mniejsze.
Ciśnienie pary może również wystąpić w idealnych mieszaninach, jak wyjaśniono prawem Raoult. Stwierdza, że częściowe ciśnienie pary określonego składnika w mieszaninie ciekłej lub stałej jest równe ciśnie pary tego komponentu pomnożonego przez frakcję molową w tej mieszaninie w danej temperaturze. Poniższy przykład ilustruje to.
Przykład 1.
Biorąc pod uwagę idealną mieszankę 0.5 mol. etanol i 1.5 mol. Metanol z ciśnieniem pary odpowiednio 30 kPa i 52 kPa, określa częściowe ciśnienie pary każdego składnika.
Rozwiązanie:
Całkowita liczba moli wynosi 1.5mol + 0.5mol = 2.0mol. Zgodnie z prawem Raoult, częściowe ciśnienie pary jest równe ciśnieniu pary pomnożonym przez frakcję molową tego konkretnego składnika. W tym przypadku Pmetanol = 1.5/2 * 52 = 39 kPa i Petanol = 0.5/2 * 30 = 7.5kpa.
Gdy masz częściowe ciśnienie pary komponentów w mieszance, możesz uzyskać całkowite ciśnienie pary, dodając je razem. Pod tym względem 7.5 + 39 daje 46.Całkowite ciśnienie pary 5 kPa mieszaniny roztworów etanolu i metanolu.
Czynniki wpływające na ciśnienie pary
Tożsamość cząsteczek
Jak już wspomniano powyżej, typy sił molekularnych określają ilość ciśnienia pary, które należy wywierać. Jeśli siły są silniejsze, wówczas pojawia się mniej ciśnienia pary, a jeśli słabsze, wówczas powstaje większe ciśnienie pary. Dlatego skład cieczy lub ciała stałego wpłynie na ciśnienie pary.
Temperatura
Wyższa temperatura prowadzi do wyższego ciśnienia pary, ponieważ aktywuje więcej energii kinetycznej, aby rozbić siły molekularne, aby cząsteczki mogły szybko uciec od powierzchni ciekłej. Gdy ciśnienie pary (nasycone ciśnienie pary) równa się ciśnieniu zewnętrzne (ciśnienie atmosferyczne), ciecz zacznie się gotować. Niższa temperatura spowoduje niskie ciśnienie pary i zagotuje się trochę czasu.

Prawo częściowo presji Daltona
Czym jest presja częściowa?
Pomysł częściowej presji został po raz pierwszy zaproponowany przez znanego naukowca Johna Daltona. Urodził jego prawo częściowej presji, które stwierdza, że całkowite ciśnienie wywierane przez idealną mieszankę gazów jest równe sumie ciśnienia częściowego poszczególnych gazów. Powiedzmy, że konkretny pojemnik jest wypełniony wodorem, azotem i tlenem, całkowite ciśnienie, pCAŁKOWITY, będzie równe sumie tlenu, azotu i wodoru. Częściowe ciśnienie dowolnego gazu w tej mieszaninie jest obliczane przez pomnożenie całkowitego ciśnienia przez frakcję molową poszczególnych gazów.
W skrócie, częściowe ciśnienie to ciśnienie wywierane przez określony gaz w mieszaninie, jakby działał sam w układzie. W ten sposób ignorujesz inne gazowe, podczas określania ciśnienia częściowego pojedynczego gazu. Teorię tę można zweryfikować poprzez wstrzyknięcie, powiedzmy, 0.6atm O2 w 10.0 l pojemnik na 230k, a następnie wstrzyknięcie 0.4atm n2 w identycznym pojemniku o tej samej wielkości w tej samej temperaturze, a następnie ostatecznie łączyć gazy do pomiaru całkowitego ciśnienia; będzie to suma dwóch gazów. To wyraźnie wyjaśnia ciśnienie częściowe poszczególnych gazów w mieszaninie niereaktywnych gazów.
Obliczanie ciśnienia częściowego
Obliczenie presji częściowej jest bezwzględną bryza, ponieważ prawo Daltona [1] zapewnia na to przepisy. Będzie to zależeć od typowych podanych informacji. Jeśli na przykład podano całkowite ciśnienie dla mieszaniny gazu A i B, a także ciśnienie gazu A, ciśnienie częściowe B można obliczyć za pomocą PCAŁKOWITY = PA + PB. Reszta to manipulacje algebraiczne. Ale w przypadku, gdy podano tylko całkowite ciśnienie mieszaniny, możesz użyć frakcji molowej gazu B do ustalenia, to ciśnienie częściowe. Frakcję molową, oznaczoną przez x, można znaleźć, dzieląc mole gazu B przez całkowitą mole mieszaniny gazowej. Następnie, aby znaleźć ciśnienie częściowe, pomnoż się frakcja molowa, x, przez całkowite ciśnienie. Poniższy przykład wyjaśnia to.
Przykład 2.
Mieszanina azotu i tlenu, z 2.5 moli i 1.Odpowiednio 85 moli jest wstrzykiwane w 20.Pojemnik 0l o całkowitych ciśnienia 4ATM; Oblicz ciśnienie częściowe wywierane przez gaz tlenu.
Rozwiązanie:
Całkowita liczba moli w mieszaninie wynosi 2.5 + 1.85 = 4.35 moli. Tak więc frakcja molowa tlenu, xo, będzie 1.85 moli/4.35 moli = 0.425 moli. Częściowe ciśnienie tlenu wyniesie 0.425 * 4atm = 1.7atm. Częściowe ciśnienie pozostałego gazu można obliczyć zgodnie z tym samym podejściem lub może być obliczone za pomocą gazu tlenu i całkowitego ciśnienia opracowanego przez prawo częściowe Daltona, że całkowite ciśnienie gazów niereaktywnych jest równe sumie z sumą z Naciski częściowe.
Różnica między pary a ciśnieniem częściowym
Od wyjaśnień wynika, że ciśnienie pary i ciśnienie częściowe są dwoma odrębnymi ciśnieniami. Ciśnienie pary stosuje się na fazie ciekłej i stałej, podczas gdy ciśnienie częściowe stosuje się na fazie gazowej. Ciśnienie pary wywiera się w przejściu fazowym po dodaniu wystarczającego ciepła do roztworu, co prowadzi do jego cząsteczek do ucieczki w układzie zamkniętym.
Główną różnicą między ciśnieniem częściowym a ciśnieniem pary polega na tym, że ciśnienie częściowe wywiera ciśnienie wywierane przez pojedynczy gaz w mieszaninie tak, jakby był sam w tym układzie, podczas gdy ciśnienie pary odnosi się do ciśnienia wywieranego przez pary w jej równowagi termodynamicznej z równowagą termodynamiczną z równowagą termodynamiczną z jego skondensowany stan cieczy lub stałej. Poniższa tabela zawiera zwięzłe porównanie tych presji.
| Ciśnienie pary | Ciśnienie cząstkowe |
| Jest wywierany przez pary cieczowe lub stałe na fazie skondensowanej w równowadze | Wywiera go poszczególne gazy w niereaktywnej mieszaninie gazowej |
| Dobrze wyjaśnione prawem Raoulta | Dobrze wyjaśnione prawem Daltona |
| Mające zastosowanie w fazach stałych i ciekłych | Dotyczy tylko w fazach gazowych |
| Niezależne od powierzchni lub objętości systemu | Obliczone za pomocą gazów w tej samej objętości |
| Obliczone za pomocą frakcji molowej substancji rozpuszczonej | Obliczone za pomocą frakcji molowej gazu |
Zakończyć!
Ciśnienie pary i ciśnienie częściowe to dwa ważne terminy naukowe stosowane w określaniu skutków sił przyłożonych odpowiednio przez oparę i gazy w danym układzie zamkniętym w określonych temperaturach. Ich główną różnicą jest obszar zastosowania z ciśnieniem pary przyłożonym na fazę cieczy lub stałą, podczas gdy ciśnienie częściowe jest stosowane na pojedynczy gaz w mieszaninie gazów idealnych w danej objętości.
Ciśnienie częściowe jest łatwo obliczane przez przestrzeganie prawa presji częściowej Daltona, podczas gdy ciśnienie pary jest obliczane przez zastosowanie prawa Raoulta. W dowolnej mieszaninie każdy składnik gazu wywiera własne ciśnienie, które nazywa się ciśnieniem częściowym niezależnym od innych gazów. A kiedy podwoisz mole dowolnego składnika z pozostałą temperaturą, zwiększysz jego ciśnienie częściowe. Zgodnie z relacją Clausiusa-Clapeyrona [2] ciśnienie pary wzrasta wraz ze wzrostem temperatury.
Z wyżej wymienionymi informacjami powinieneś być w stanie rozróżnić ciśnienie pary od ciśnienia częściowego. Powinieneś być również w stanie obliczyć je za pomocą frakcji molowych i mnożącym przez całkowite ciśnienie. Podaliśmy typowe przykłady do rozwinięcia zastosowania tych presji.

