Różnica między molowością a molowością
- 1720
- 321
- Maksym Cieślik
Co to jest molowość?
Molarność można zdefiniować jako liczbę moli substancji (znanej jako substancja rozpuszczona), która jest rozpuszczona w dokładnie 1 litrach roztworu (rozpuszczalnik i substancja rozpuszczona).
Wzór obliczania molowości jest zatem następujący:
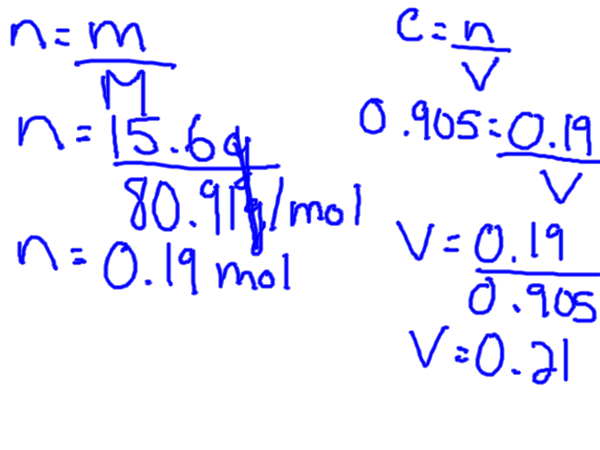
M = roztwór substancji rozpuszczonej Mole / L
Molarność jest również powszechnie określana jako stężenie molowe. Dlatego miara stężenia molowego w oparciu o objętość cieczy, w której substancja jest rozpuszczana. Ważne jest, aby zdać sobie sprawę, że głośność jest w litrach, więc być może będziesz musiał najpierw konwertować, jeśli masz na przykład wolumen w ML.
Aby przygotować stężenie molowe, dodaje się do kolby objętościowej znanej ilości substancji rozpuszczonej.

Na przykład: Można stworzyć pewne stężenie trzonowe cukru. Waga cukru najpierw musi zostać przekształcona w mole, a następnie dodaje się woda do osiągnięcia 1 litra.
Aby obliczyć molowość, potrzebujesz substancji rozpuszczonej w molach, ale zwykle będziesz mieć pewną wagę substancji rozpuszczonej, co oznacza, że najpierw musisz przekształcić gram w mole. Można to zrobić, znajdując masę molową substancji rozpuszczonej z stolika okresowego.
Wzór stężenia molowego można zmienić, aby rozwiązać zarówno dla objętości, jak i moli.
Na objętość wpływają zmiany temperatury lub ciśnienia. Na przykład objętość wzrośnie wraz ze wzrostem temperatury. Oznacza to, że pojawią się kwestia dokładności, w których nastąpi zmiany temperatury.
Jeśli temperatura spadnie wystarczająco, wówczas ciecz może się skupić, powodując wzrost molowości, ponieważ pozostaje ta sama liczba moli, ale byłoby mniej roztworu.
I odwrotnie, jeśli temperatura wzrośnie wystarczająco, ciecz może się zwiększyć, powodując zmniejszenie molowości, ponieważ pozostaje ta sama liczba moli, ale byłoby bardziej roztwór.
Do obliczenia stężenia substancji, która została rozcieńczona.
Można użyć molowości, gdy dokładna precyzja nie jest wymagana. Wpływają jednak zmiany temperatury, ponieważ są to pomiar objętościowy, więc w niektórych przypadkach może nie być właściwe użycie.
Molowa i molowość mogą być takie same w niektórych przypadkach. Na przykład 1 litr wody waży 1 kg.
Co to jest molialność?
Molowość można zdefiniować jako liczbę moli substancji (znanej jako substancja rozpuszczona), która występuje w pewnej masie rozpuszczalnika podanej w kg, że jest ona rozpuszczona.
Wzór do obliczania molowości Jest :
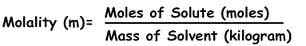
M = rozpuszczalnik substancji rozpuszczalnika / kg
Molowość jest również określana jako stężenie cząsteczkowe.
Przykładem tworzenia stężenia moli było na przykład wagę określonej ilości cukru. Należy to następnie przekształcić w liczbę moli przy użyciu masy cząsteczkowej cukru. Następnie zlewka wody jest ważona, a do zlewki dodaje się woda, aż waży 1 kg.
Cukier jest następnie dodawany do zlewki wody i rozpuszcza się.
Zaletą molowości nad molowością jest to, że nie mają wpływu zmiany temperatury i ciśnienia, ponieważ jest obliczane na podstawie masy, a nie objętości. Temperatura nie ma wpływu na masę rozpuszczalnika w sposób, w jaki objętość substancji jest, dlatego molialność jest dokładniejszą miarą stężenia niż molowość.
W przypadku wody trzonowość i molowość mogą być takie same, ponieważ 1 litr wody waży 1 kg, jednak może tak nie było w przypadku wszystkich cieczy.
Oznacza to, że należy stosować molowości, gdy dotyczy to właściwości koligatywnych.
Molelność jest dokładniejsza i zapewnia większą precyzję stężenia, ale przygotowanie trwa dłużej, ponieważ substancja rozpuszczona musi być dodana do ciężaru rozpuszczalnika. Jeśli rozpuszczalnik jest płynny, należy to zważyć.
Można to zrobić za pomocą układu grawimetrycznego i równowagi analitycznej, aby zważyć rozpuszczalnik.
Jaka jest różnica między molowością a molowością?
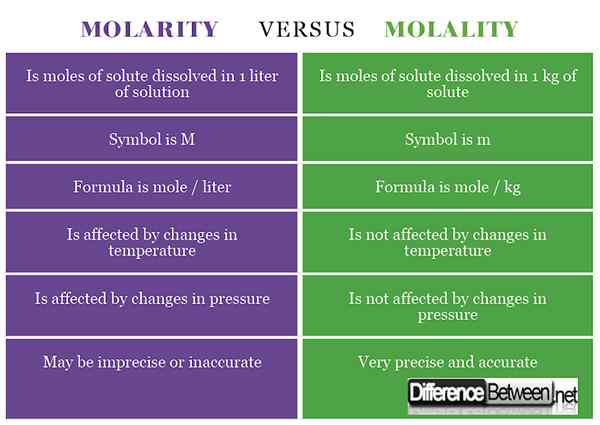
1) Molarność jest stężeniem substancji, która jest obliczana jako liczba moli substancji rozpuszczonej, która jest rozpuszczona w 1 litrach roztworu, podczas gdy molowość jest stężeniem substancji, która jest obliczana jako liczba moli substancji rozpuszczonej w 1 kg rozpuszczalnika.
2) Symbkiem molowości jest m, podczas gdy dla molowości jest M (czasami napisane jako -m lub M odróżnić go od masy).
3) Wzór molowości to mole / litr, podczas gdy wzór dla moliczności jest mole / kg.
4) Wpływ na molowość wpływają zmiany temperatury, natomiast molelności nie mają wpływu zmiany temperatury.
5) Wpływa na molowość zmiany ciśnienia, podczas gdy moliowość nie wpływają zmiany ciśnienia.
6) Molarność może powodować nieprecyzyjne i niedokładne stężenie, podczas gdy molialność powoduje dokładny dokładny pomiar stężenia.
Tabela porównująca trzonowość i molowość
Podsumowanie molowości i molowości
- Zarówno mololowość, jak i molowość można wykorzystać do pomiaru stężenia.
- Molarność jest definiowana jako liczba moli substancji rozpuszczonej, które rozpuszczane są w 1 litorze roztworu.
- Molowość jest definiowana jako liczba moli substancji rozpuszczonej, które rozpuszczane są w 1 kg rozpuszczalnika.
- Molelność jest bardziej precyzyjnym i dokładnym sposobem na tworzenie pewnego stężenia, ponieważ zmiany temperatury i ciśnienia nie mają wpływu.
- Molarność obejmuje ciecz, co oznacza, że stężenie może się zmienić. Wynika to z faktu, że objętość jest cieczy, może zmienić się wraz ze zmianami temperatury i ciśnienia.
- « Różnica między niepełnosprawnością intelektualną a niepełnosprawnością rozwojową
- Różnica między Groupby i Orderby »

