Różnica między komórkami galwanicznymi a komórkami elektrolitycznymi
- 4470
- 1308
- Pani — Jóźwiak
Istnieją dwa rodzaje komórek elektrochemicznych: komórki galwaniczne - ze spontanicznymi procesami redoks, które umożliwiają ciągły przepływ elektronów przez przewodnik, przy czym energia chemiczna jest przekształcana w elektryczne; i elektrolityczne, gdzie na reakcje redoks wpływa zewnętrzne źródło prądu, w którym elektryczność jest przekształcana w energię chemiczną.

Co to jest komórka galwaniczna?
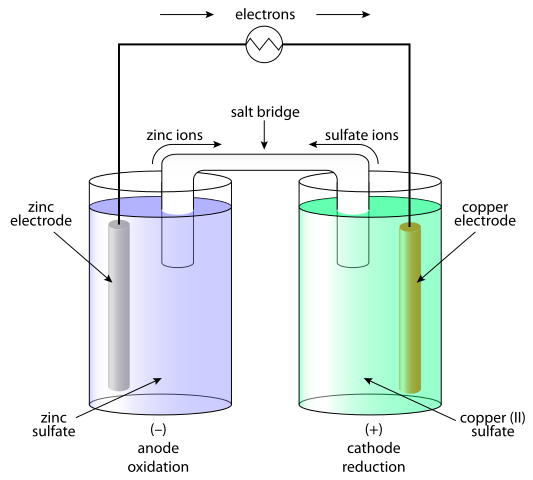
Komórki galwaniczne to układy, w których energia chemiczna jest przekształcana w elektryczne, aw wyniku generowania prądu. W komórkach galwanicznych prąd stały jest generowany w wyniku procesu redoks (redukcja utleniania). Element galwaniczny składa się z dwóch półkomórki. Półokomórka składa się z elektrolitu i zanurzonej elektrody. Pomiędzy tymi półkomórkami należy zapewnić kontakt, łącząc elektrolit z mostkiem solnym lub membraną półprzewodową i łączenie elektrody przewodnikiem. Oddzielenie procesu redoks jest wyjaśnione przez zachowanie elektrod w odniesieniu do elektrolitu. Najprostszą opcją jest to, że półkomórka jest utworzona z metalowej elektrody zanurzonej w elektrolicie korespondencji elektrody. Zachowanie metali w elektrolicie zależy od reaktywności metalu I.mi. jego tendencja do rozpuszczania.
Co to jest komórka elektrolityczna?
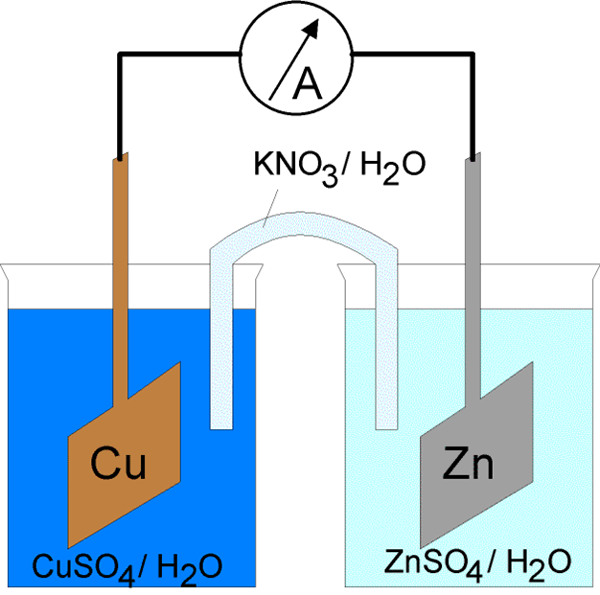
Prąd elektryczny przez komórkę elektrochemiczną można zainicjować na dwa sposoby. Pierwszym z nich jest podłączenie elektrod z przewodnikiem do zamkniętego obwodu elektrycznego. Zamykając obwód elektryczny, możliwe jest spontaniczne indukowanie reakcji elektrody na obu fazach metalu/elektrolitu. Ponadto energia prądu jest uwalniana kosztem energii spontanicznej reakcji chemicznej. Komórka, która działa w ten sposób, nazywa się komórką galwaniczną. To zostało wyjaśnione powyżej. Innym sposobem jest zamknięcie obwodu elektrycznego przez szeregowe wiązanie zewnętrznego źródła prądu w przeciwieństwie do napięcia ogniwa, w którym napięcie zewnętrzne jest większe niż siła elektromotoryczna ogniwa. Napędza prąd w przeciwnym kierunku od kierunku jego spontanicznego przepływu przez komórkę. Z tego powodu reakcje elektrod w komórce muszą być sprzeczne z kierunkiem ich spontanicznego przepływu. Wymuszone procesy w komórce elektrochemicznej pod wpływem zewnętrznego źródła prądu elektrycznego nazywane są elektrolizą, a ogniwa elektrochemiczne w takim trybie działania nazywane jest ogniwą elektrolityczną.
Różnica między komórką galwaniczną i elektrolityczną
-
Definicja ogniwa galwanicznego i elektrolitycznego
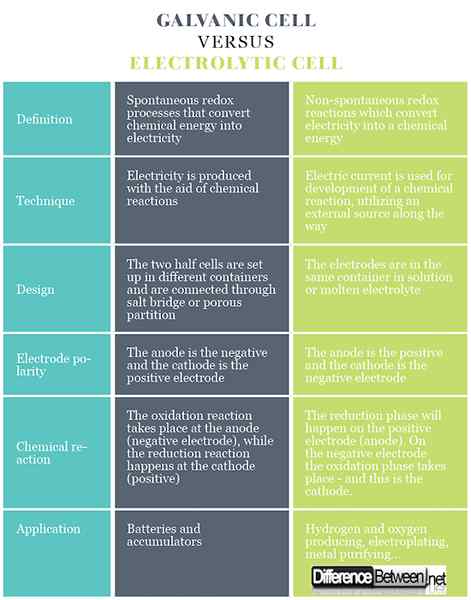
W komórkach galwanicznych istnieją spontaniczne procesy redoks, które umożliwiają ciągły przepływ elektronów przez przewodnik, w którym energia chemiczna jest przekształcana w elektryczne. W komórce elektrolitycznej reakcje redoks zachodzą pod wpływem źródła zewnętrznego, w którym elektryczność jest przekształcana w energię chemiczną. Reakcje redoks są niefontaniczne.
-
Technika ogniwa galwanicznego i elektrolitycznego
Komórki galwaniczne wytwarzają energię elektryczną za pomocą reakcji chemicznych. W komórkach elektrolitycznych do opracowania reakcji chemicznej stosuje się prąd elektryczny, wykorzystując zewnętrzne źródło po drodze.
-
Projekt ogniwa galwanicznego i elektrolitycznego
Komórki galwaniczne składają się z dwóch różnych elektrod zanurzonych w roztworach ich jonów, które są oddzielone półprzepuszczalną membraną lub mostkiem solnym. Komórki elektrolityczne składają się z pojemnika elektrolitycznego, w którym dwie elektrody są podłączone do źródła DC. Elektrolit może być stopem lub wodnym roztworem niektórych soli, kwasu lub alkalicznego.
-
Polaryzacja elektrody w ogniwie galwanicznym i elektrolitycznym
W komórkach galwanicznych anoda jest ujemna, a katoda jest elektrodą dodatnią. W komórkach elektrolitycznych występuje odwrotnie.
-
Reakcja chemiczna w komórce galwanicznej i elektrolitycznej
W przypadku komórki galwanicznej reakcja utleniania zachodzi na anodzie (elektrodę ujemną), gdzie istnieje nadwyżka ładunku ujemnego. Na katodzie następuje reakcja redukcji, wywołując pozytywne gromadzenie się ładunku. W przypadku ogniwa elektrolitycznego stosuje się źródło zewnętrzne do wyzwolenia reakcji. Przy elektrodzie ujemnej elektrony są z niej wypychane - więc faza redukcji nastąpi na elektrodzie ujemnej. Na elektrodzie dodatniej faza utleniania zachodzi - i jest to anoda.
-
Zastosowanie ogniwa galwanicznego i elektrolitycznego
Komórki galwaniczne są używane jako źródło prądu elektrycznego i są częściej określane jako akumulatory lub akumulatory. Komórki elektrolityczne mają różne praktyczne zastosowania, niektóre z nich to wytwarzanie wodoru i tlenu do zastosowań komercyjnych i przemysłowych, galwanizacja, ekstrakcja czystych metali ze stopów i tak dalej.
Galvanic vs. Komórka elektrolityczna: porównanie w postaci tabelary
Podsumowanie galwanika vs. Komórka elektrolityczna
- Komórka elektrochemiczna składa się z dwóch półkomórków lub elektrod, których kontakt jest wytwarzany za pomocą elektrolitu (przewodnik jonowy). Półkomorki, jeśli są oddzielone, można połączyć mostkiem solnym (stężony roztwór elektrolitów w żelu agar-agar). Komórka galwaniczna wytwarza prąd elektryczny na podstawie zmiany chemicznej, która występuje w nim spontanicznie. Komórka elektrolityczna robi dokładnie odwrotnie: prąd powoduje zmianę chemiczną. Aby komórka była galwaniczna, musi w nim wystąpić spontaniczna zmiana chemiczna.

