Różnica między widmami emisji i absorpcji
- 1500
- 375
- Klarencjusz Rybak

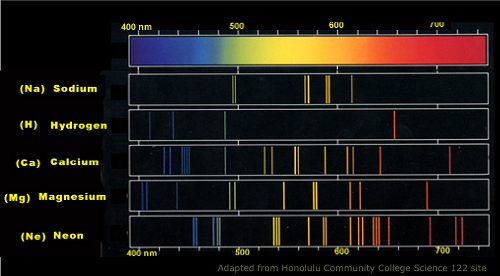
Spektrum emisji atomowej sodu
Emisja vs. Widma absorpcyjne
Chemik mający na celu odkrycie składu elementarnego określonej substancji lub roztworu może różnicować atomy poprzez spektroskopię emisji i/lub absorpcji. Oba procesy są ukierunkowane na obserwację elektronów i fotonów, gdy są poddawane światło. Następnie w tych procesach potrzebny jest spektrofotometr wraz ze źródłem światła. Naukowiec musi mieć listę wartości zarówno dla emisji absorpcji dla każdego atomu przed poddaniem substancji spektroskopii.
Na przykład, gdy naukowiec odkrywa próbkę z odległego obszaru i ma na celu poznanie składu sprawy, może zdecydować się na poddanie próbki spektroskopii emisji lub absorpcji. W widmach absorpcyjnych powinien obserwować, w jaki sposób elektrony atomów wchłaniają energię elektromagnetyczną ze źródła światła. Gdy światło jest skierowane na atomy, jony lub cząsteczki, cząstki mają tendencję do wchłaniania długości fali, które mogą je podniecić i powodować przemieszczenie się z jednej kwantowej do drugiej. Spektrofotometr może rejestrować ilość zaabsorbowanej długości fali, a naukowiec może następnie odnieść się do listy charakterystyk elementu, aby określić skład zebranej próbki.
Widma emisji są wykonywane z tym samym procesem podporządkowania światła. Jednak w tych procesach naukowiec obserwuje ilość światła lub energii cieplnej emitowanej przez fotony atomu, które sprawiają, że wrócą do pierwotnej kwantowej.
Pomyśl o tym w ten sposób: słońce jest centrum atomu, składającego się z fotonów i neutronów. Planety krążące wokół słońca to elektrony. Kiedy gigantyczna latarka jest skierowana w kierunku Ziemi (jako elektron), Ziemia staje się podekscytowana i przesuwa się na orbitę Neptuna. Energia pochłonięta przez Ziemię jest rejestrowana w widmach absorpcyjnych.
Po usunięciu gigantycznej latarki Ziemia emituje światło, aby wróciła do pierwotnego stanu. W takich przypadkach spektrofotometr rejestruje ilość długości fali emitowanej przez Ziemię, aby naukowcy mógł określić rodzaj elementów składających się z układu słonecznego.
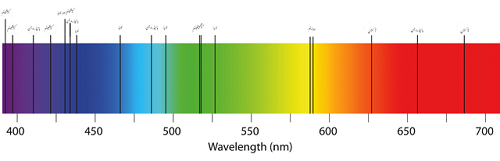
Widmo absorpcji kilku pierwiastków
Oprócz tego absorpcja nie wymaga wzbudzenia jonów lub atomów, w przeciwieństwie do widm emisji. Oba muszą mieć źródło światła, ale powinny one różnić się w dwóch procesach. Lampy kwarcowe są zwykle stosowane w absorpcji, podczas gdy palniki są odpowiednie do widm emisji.
Kolejna różnica między tymi dwoma widmami jest wyjście „wydruku”. Opracowując na przykład zdjęcie, spektrum emisji jest kolorową fotografią, podczas gdy widmo absorpcyjne jest wydrukiem ujemnym. Oto dlaczego: widma emisji mogą emitować światło, które rozciąga się na różne zakresy widma elektromagnetycznego, wytwarzając w ten sposób kolorowe linie z niską energią fal radiowych do promieni gamma o wyższej energii. Kolory w pryzmatach są zwykle obserwowane w tych widmach.
Z drugiej strony absorpcja może emitować kilka kolorów w połączeniu z pustymi liniami. Wynika to z faktu, że atomy absorbują światło przy częstotliwości zależnej od rodzaju elementów obecnych w próbce. Ponowne wydane światło w procesie raczej nie zostanie emitowane w tym samym kierunku, w którym pochodzi wchłonięty foton. Ponieważ światło z atomu nie można skierować w stronę naukowca, światła wydaje się mieć czarne linie z powodu brakujących fal w widmach elektromagnetycznych.
Streszczenie:
1.Widma emisji i absorpcji można zastosować do określania składu materii.
2.Oba używają źródła światła i spektrofotometru.
3.Widma emisji mierz długość fali emitowanego światła po wzbudzeniu atomów, podczas gdy absorpcja mierzy długość fali pochłoniętej przez atom.
4.Widma emisji emitują wszystkie kolory w spektrum elektromagnetycznym, podczas gdy wchłanianie może brakować kilku kolorów z powodu przekierowania ponownego emisji fotonów zaabsorbowanych.

