Różnica między geometrią elektronów a geometrią molekularną
- 3009
- 57
- Paula Pilch
Chemia jest badaniem materii i dotyczy wielu sposobów, w jaki jeden rodzaj materii można zmienić na inne rodzaje. Wiadomo, że cała materia jest wykonana z jednego lub więcej z około stu różnych rodzajów atomu. Wszystkie atomy składają się z trzech podstawowych cząstek - protonów, elektronów i neutronów. Cząsteczka składa się z grupy dwóch lub więcej atomów trzymanych razem w określonym wzorze geometrycznym. Gdy dwa lub więcej atomów jest mocno trzymane razem, aby utworzyć cząsteczkę, między każdym atomem i jej bliskimi sąsiadami występują wiązania chemiczne. Kształt cząsteczki przekazuje bogactwo informacji, a pierwszym krokiem do zrozumienia chemii cząsteczki jest poznanie jej geometrii.
Geometria molekularna po prostu odnosi się do trójwymiarowego układu atomów, które stanowią cząsteczkę. Termin struktura jest raczej używana w pewnym sensie, aby wskazać po prostu łączność atomów. Kształt cząsteczki jest określany w kategoriach odległości między jądermi atomowymi, które są połączone. Geometria cząsteczek jest określana przez teorię odpychania pary elektronowej walencyjnej (VESPR)- model zastosowany do określenia ogólnego kształtu cząsteczki w oparciu o liczbę par elektronów wokół centralnego atomu atomu. Geometria cząsteczki jest podana albo jako geometria elektronów lub geometria molekularna.

Co to jest geometria elektronów?
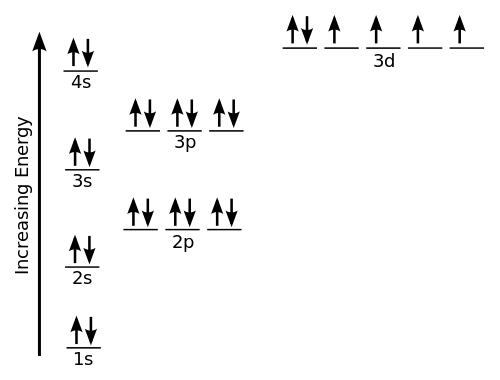
Termin geometria elektronów odnosi się do nazwy geometrii pary/grup/domen elektronów na atomie centralnym, niezależnie od tego, czy są to elektrony, czy elektrony nieobowiązkowe. Pary elektronowe są zdefiniowane jako elektrony w parach lub wiązaniach, samotne pary, a czasem pojedynczy niesparowany elektron. Ponieważ elektrony są zawsze w stałym ruchu, a ich ścieżki nie można dokładnie zdefiniować, układ elektronów w cząsteczce jest opisany w kategoriach rozkładu gęstości elektronów. Weźmy przykład metanu, którego chemikalia jest CH4. Tutaj centralnym atomem jest węgiel z 4 elektronami walencyjnymi i 4 wodorem dzielącymi elektrony z 1 węglem z 4 wiązaniami kowalencyjnymi. Oznacza to, że wokół węgla jest łącznie 8 elektronów i nie ma pojedynczych wiązań, więc liczba samotnych par wynosi 0. Sugeruje Ch4 jest geometrią czworościenną.
Czym jest geometria molekularna?
Geometria molekularna służy do określenia kształtu cząsteczki. Po prostu odnosi się do trójwymiarowego układu lub struktury atomów w cząsteczce. Zrozumienie geometrii molekularnej związku pomaga określić reaktywność, polarność, kolor, fazę materii i magnetyzm. Geometria cząsteczki jest zwykle opisywana w kategoriach długości wiązania, kątów wiązania i kąty skrętnej. W przypadku małych cząsteczek wzór molekularny i tabela standardowych długości i kąty wiązania mogą być wszystkim, co jest wymagane do określenia geometrii cząsteczki. W przeciwieństwie do geometrii elektronów, przewiduje się, biorąc pod uwagę tylko pary elektronów. Weźmy przykład wody (h2O). Tutaj tlen (O) jest atomem centralnym z 6 elektronami walencyjnymi, więc wymaga 2 więcej elektronów z 2 atomów wodoru, aby ukończyć okett. Więc istnieją 4 grupy elektronowe ułożone w czworościennym kształcie. Istnieją również 2 pary pojedynczych wiązań, więc wynikowy kształt jest wygięty.
Różnica między geometrią elektronów a geometrią molekularną
Terminologia geometrii elektronów i geometrii molekularnej
Termin geometria elektronów odnosi się do nazwy geometrii pary/grup/domen elektronów na atomie centralnym, niezależnie od tego, czy są to elektrony, czy elektrony nieobowiązkowe. Pomaga zrozumieć, w jaki sposób różne grupy elektronowe są ułożone w cząsteczce. Z drugiej strony geometria molekularna określa kształt cząsteczki i jest to trójwymiarowa struktura atomów w cząsteczce. Pomaga zrozumieć cały atom i jego aranżacja.
Geometria
Geometria cząsteczki jest określana na podstawie tylko wiązania par elektronów, ale nie liczby par elektronów. Jest to trójwymiarowy kształt, który cząsteczka zajmuje w przestrzeni. Geometria molekularna jest również definiowana jako pozycje jąder atomowych w cząsteczce. Z drugiej strony geometria elektronów cząsteczki jest określana na podstawie zarówno pary wiązania elektronów, jak i samotnych par elektronów. Geometrię elektronów można określić za pomocą teorii VESPR.
Przykłady geometrii elektronów i geometrii molekularnej
Jednym z wielu przykładów czworościennej geometrii elektronów jest amoniak (NH3). Centralny atom tutaj to n, a cztery pary elektronów są rozmieszczone w kształcie tetrahedronu z tylko jedną samotną parą elektronów. Zatem geometria elektronów NH3 jest czworościenna. Jednak jego geometria molekularna jest piramida trygonalna, ponieważ kąty wiązania wynoszą 107 stopni, ponieważ atomy wodoru są odpychane przez samotną parę elektronów wokół azotu. Podobnie geometria molekularna wody (h2O) jest wygięty, ponieważ istnieją 2 pary pojedynczych wiązań.
Geometria elektronów vs. Geometria molekularna: wykres porównawczy

Podsumowanie geometrii elektronów vs. Geometria molekularna
Zarówno geometria elektronów, jak i geometria molekularna są zgodne z modelem odpychania pary elektronowej (VESPR) walencyjnej, aby określić ogólny kształt cząsteczki w oparciu o liczbę par elektronów wokół środkowego atomu. Jednak geometria molekularna jest określana wyłącznie na podstawie wiązania par elektronów, a nie liczby pary elektronów, podczas gdy geometria elektronów jest określana na podstawie zarówno par wiązania elektronów, jak i samotnych par elektronów. Gdy w cząsteczce nie ma żadnych samotnych par elektronów, geometria elektronów jest taka sama jak kształt molekularny. Jak powiedzieliśmy, kształt cząsteczki wiele o tym mówi, a pierwszym krokiem do zrozumienia chemii cząsteczki jest określenie jej geometrii.

