Różnica między krystaliczną i amorficzną

- 3136
- 180
- Emilia Rudziński
Amorficzne i krystaliczne to dwa stany, które opisują typowe stałe w chemii. Stosując eksperymenty dyfrakcji rentgenowskiej, strukturę ciał stałych można podzielić na krystaliczne lub amorficzne (niekrystaliczne).
Solidne są jednymi z trzech podstawowych stanów materii, które obejmują ciecze i gazowe. Charakteryzują się sztywną strukturą cząsteczek, jonów i atomów ułożonych w sposób uporządkowany. Te uporządkowane lub nieorządowe ustalenia doprowadziły do kategoryzacji jako amorficznej i krystalicznej, a ten artykuł rozwija kluczowe różnice między tymi dwoma terminami.

Co jest krystaliczne?
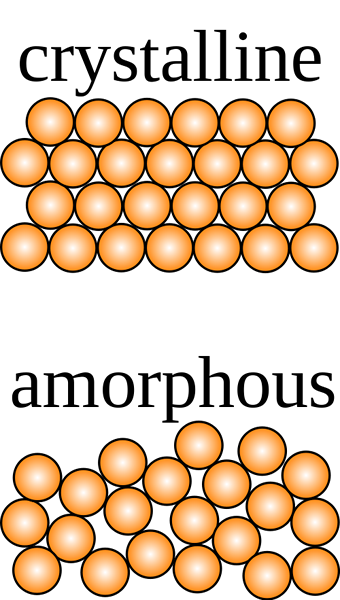
Krystaliczna substancja stała jest taka, w której cząsteczki składowe są uporządkowane w trójwymiarowym wzorze zwanym kryształową siecią o jednolitych sił międzycząsteczkowych, a cząstki przecinają się pod kątem charakterystycznym kryształu.
Struktura wewnętrzna ma wyraźny kształt geometryczny i pokazuje wyraźne rozszczepienie po przecięciu w dowolnym miejscu w strukturze. Trójwymiarowy wzór widoczny za pomocą promieni rentgenowskich jest używany do identyfikacji stałego. Nie jest jednak łatwe do wykrycia różnicy między krystalicznymi i niekrystalicznymi ciałami stałymi, dotykając ich. Różnią się od siebie w wielu aspektach, w tym właściwości chemiczne i fizyczne.
Krystaliczne stałe (kryształy) potrzebują ekstremalnych temperatur, aby rozbić siły międzycząsteczkowe. Mają określone ciepło fuzji i temperatur topnienia ze względu na jednolity układ ich składników. Lokalne środowisko jest również jednolite. Jednak po przecięciu w dowolnym kierunku właściwości fizyczne są różne znane w ten sposób jako anizotropowe. Po obróceniu wokół osi struktura kryształów pozostaje taka sama i nazywana jest symetrycznym układem cząsteczek, atomów lub jonów.
Niektóre krystaliczne stałe mogą być amorficzne w zależności od procesu chłodzenia. Inni mogą mieć źle uwzględnione elementy z powodu obecności zanieczyszczeń. Również substancje chłodzące szybko mogą prowadzić do amorficznej struktury z nieregularnymi kształtami geometrycznymi. Na przykład kwarc jest krystaliczny z atomami silikonu i tlenu w uporządkowany sposób. Ale po szybkim schłodzeniu może prowadzić do amorficznego szkła konstrukcyjnego. Zwykle zdarza się, że proces krystalizacji jest unikany przez szybkie topienie substancji w celu wytworzenia amorficznych stałych ze względu na ich obszerne zastosowania przemysłowe. Guma, polimer i szkło należą do idealnych przykładów ważnych amorficznych substancji stałych w dużej mierze z ich ogromnych korzyści i unikalnych właściwości izotropowych.
Współczynnik załamania światła, wytrzymałość mechaniczna, przewodność cieplna i przewodność elektryczna krystalicznych stałych różnią się w różnych kierunkach. To jest minus tego rodzaju ciał stałych w porównaniu z niekrystalicznymi ciałami stałymi. Dobrą stroną anizotropowej substancji stałej jest to, że oznacza ona doskonale ułożoną strukturę wewnętrzną z jednolitymi siłami atrakcji w kryształowej sieci. Przedstawia prawdziwe właściwości stałego z rzędu dalekiego zasięgu i sztywną strukturę.
Co jest amorficzne?
Słowo amorficzne pochodzi od greckiego słowa amorficznego, co oznacza „bezkształtne”. To jest bezkształtne, nieuporządkowane i nieregularne rozmieszczenie cząstek składowych stałego. Ich siły międzycząsteczkowe nie są takie same, ani odległości między cząsteczkami. Po odszczepie amorficzne stałe dają fragmenty lub zakrzywione powierzchnie z powodu nieregularnych kształtów geometrycznych.
Niektóre amorficzne stałe mogą mieć części uporządkowanych wzorów, które nazywane są krystality. Atomy, jony lub cząsteczki ciała stałego zależą od procesu chłodzenia. Jak wspomniano, kryształ kwarcowy różni się wraz z kwarcowym szkłem ze względu na proces krystalizacji. Ale ogólnie wiele amorficznych ciał stałych ma nieuporządkowany wzór. Zazwyczaj nazywane są super chłodzonymi ciałami stałymi, ponieważ struktura ma niektóre właściwości z cieczami. Ponadto nie pokazują prawdziwych właściwości ciał stałych, ale są jednak głównie używane w wielu zastosowaniach.
Przewodność cieplna, wytrzymałość mechaniczna, przewodność elektryczna i współczynnik załamania są takie same we wszystkich kierunkach amorficznych ciał stałych. To wyjaśnia, skąd pochodzi nazwa izotropowa. Solidki nie mają ostrych temperatur topnienia ani określonego ciepła fuzji. Należy zastosować szeroki zakres temperatury, zanim będą mogły się stopić z powodu braku uporządkowanej tablicy komponentów. Ponadto amorficzne ciałę stałe charakteryzują. Przykłady amorficznych ciał stałych obejmują polimery, gumy, tworzywa sztuczne i szkło.
Jeśli amorficzna substancja substancji stała pozostaje przez długi czas poniżej jego temperatury topnienia, może przekształcić się w krystaliczną substancję stałą. Może przedstawiać te same właściwości posiadane przez krystaliczne ciałę stałe.
Kluczowe różnice między amorficznym i krystalicznym
Struktura krystalicznego i amorficznego
Krystaliczne stałe mają określony kształt z uporządkowanymi jonami, cząsteczkami lub atomami we wzorze trójwymiarowym często nazywanym sieci kryształowych. W przypadku cięcia przedstawiają wyraźne rozszczepienie z powierzchniami przecinającymi się pod kątem charakterystycznym dla kryształu. Z drugiej strony amorficzne stałe mają nieuporządkowany zestaw składników, który nie wykazuje określonego kształtu. Po wycięciu wykazują nieregularne kształty zwykle z zakrzywionymi powierzchniami. Krystaliczne składniki są utrzymywane razem przez jednolite siły międzycząsteczkowe, podczas gdy w amorficznych stałych siły te różnią się od jednego atomu do drugiego.
Punkty topnienia krystalicznego i amorficznego
Amorficzne stałe nie mają określonych temperatur topnienia, ale topią się w szerokim zakresie temperatury ze względu na nieregularny kształt. Z drugiej strony krystaliczne stałe mają ostrą temperaturę topnienia.
Właściwości fizyczne krystalicznych i amorficznych
Krystaliczne stałe mają inną przewodność elektryczną, przewodność cieplną, współczynnik załamania światła i wytrzymałość mechaniczna w krysztale w różnych kierunkach, dlatego nazywane są anizotropowymi. Amorficzne nazywane są izotropą ze względu na podobne właściwości fizyczne z obu kierunków.
Przykłady krystalicznych i amorficznych
Przykłady krystalicznej substancji stałej obejmują NaCl, cukier i diament, podczas gdy przykłady amorficznych stałych obejmują szkło, gumę i polimery.
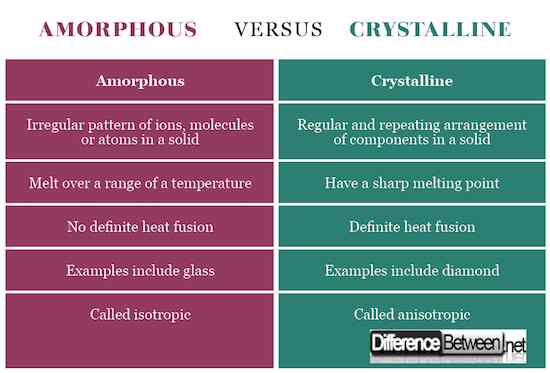
Zobacz wykres porównawczy dla krystalicznych wierszy amorficznych poniżej:
Podsumowanie krystalicznych wierszy amorficznych
- Krystaliczne stałe mają regularny trójwymiarowy wzór jonów, atomów lub cząsteczek, podczas gdy amorficzne stałe mają losowe rozmieszczenie tych składników
- Krystalne stałe mają dokładną temperaturę topnienia, podczas gdy amorficzne stałe topią się w zakresie temperatury
- Amorficzne stałe dają fragmenty o nieregularnych wzorach po rozszczepianiu, podczas gdy krystaliczne ciśnie stałe przedstawiają określony kształt
- Krystaliczne zwane anizotropowymi ze względu na różne właściwości fizyczne we wszystkich kierunkach, podczas gdy amorficzne nazywane są izotropową
- Przykłady amorficznych obejmują szkło, a krystaliczne Diamond.

