Allotropes vs. Izomery

- 1405
- 143
- Łukasz Kalisz
Alotropy to różne modyfikacje strukturalne elementu, podczas gdy izomery są związkami chemicznymi, które mają ten sam wzór molekularny, ale mają różne wzory strukturalne.
Niektóre elementy mogą istnieć w dwóch lub więcej różnych formach. Te formy są nazywane alotropy w którym atomy pierwiastka są połączone razem w inny sposób. Na przykład DiOxygen (o2), ozon (o3), tetraoksygen (o4) i oksyoksygen (o8) są alotropami tlenu. Innym przykładem jest węgiel, którego alotropy obejmują grafit i diament. Krótko mówiąc, alotropy zawierają ten sam element (te same atomy), które łączą się na różne sposoby, aby wytwarzać różne struktury molekularne.
W przeciwieństwie, izomery są związkami (Zobacz elementy vs. Związki), które mają ten sam wzór molekularny, ale mają różne wzory strukturalne. Izomery nie dzielą swoich właściwości chemicznych, chyba że należą one do tej samej grupy funkcjonalnej. Na przykład propanol ma wzór C3H8O (lub c3H7OH) i występuje jako dwa izomery: propan-1-ol (alkohol n-propyl; I) i propan-2-ol (alkohol izopropylowy; Ii). Różnica między tymi dwoma izomerami leży w pozycji atomu tlenu: jest on przyłączony do węgla końcowego w propan-1-ol i do środkowego węgla w propan-2-ol. Istnieje trzeci izomer C3H8O których właściwości są tak różne, że nie jest to alkohol (jak propanol), ale eter. Nazywany metoksyetanem (eterem metylo-etylu; Iii), ten izomer ma tlen podłączony do dwóch węgli, a nie z jednym węglem i jednym wodorem.
Wykres porównania
| Alotropy | Izomery | |
|---|---|---|
| Definicja | Alotropy to różne modyfikacje strukturalne elementu. Na przykład o i o2 | Izomery to związki chemiczne, które mają ten sam wzór molekularny, ale mają różne wzory strukturalne. |
| Przykłady | Diament, grafit itp. | 2-metylopropan-1-OL i 2-metylopropan-2-OL. |
Historia alotropów i izomerów
Zarówno alotropia, jak i izomeryzm były koncepcjami zaproponowanymi przez szwedzkiego naukowca Jönsa Jakoba Berzeliusa. Zaproponował koncepcję alotropia w 1841 r. Po przyjęciu hipotezy Avogadro w 1860 r2 i o3. Na początku XX wieku uznano, że inne przypadki, takie jak węgiel, były spowodowane różnicami w strukturze krystalicznej.
Izomeryzm został po raz pierwszy zauważony w 1827 r., Kiedy Friedrich Woehler przygotował kwas cyjanowy i zauważył, że chociaż jego skład elementarny był identyczny z kwasem fulminowym (przygotowanym przez Justus von Liebig w poprzednim roku), jego właściwości były zupełnie inne. To odkrycie zakwestionowało dominujące chemiczne zrozumienie czasu, które utrzymywało, że związki chemiczne mogą być różne tylko wtedy, gdy miały różne składy elementarne. Po dokonaniu dodatkowych odkryć tego samego rodzaju, takich jak odkrycie Woehlera z 1828 r., Że mocznik ma taki sam skład atomowy, jak chemicznie odrębny cyjaninian amonu, Jöns Jakob Berzelius wprowadził termin izomerizm Opisać to zjawisko.
Rodzaje izomerów
Różne klasy izomerów obejmują stereoizomery, enancjomery i izomery geometryczne.
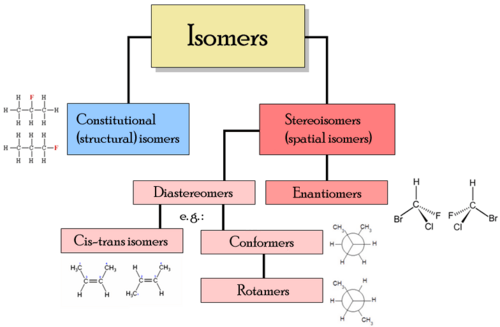 Rodzaje izomerów
Rodzaje izomerów - Izomery strukturalne - W izomerach strukturalnych atomy i grupy funkcjonalne są połączone na różne sposoby. Rodzaje izomerów strukturalnych obejmują:
- izomeryzm łańcuchowy - łańcuchy węglowodorów mają zmienne ilości rozgałęzienia
- Pozycja izomeryzm - dotyczy pozycji grupy funkcjonalnej w łańcuchu
- Izomeryzm grupy funkcjonalnej - Jedna grupa funkcjonalna jest podzielona na różne.
- izomery szkieletowe - Główny łańcuch węglowy różni się między dwoma izomerami.
- Tautomery - Izomery strukturalne tej samej substancji chemicznej, które spontanicznie łączą się ze sobą.
- Stereoizomery - W stereoizomerach struktura wiązania jest taka sama, ale geometryczne pozycjonowanie atomów i grup funkcjonalnych w przestrzeni jest różne. Rodzaje stereoizomerów obejmują:
- Enancjomery - Różne izomery są niezmiennymi lustrami
- diastereomery - Izomery nie są sobie obrazami Mirro

