Jednorodne vs. Heterogeniczne mieszanki

- 1236
- 257
- Salwator Słowiński
Mieszaniny różnią się od czystych substancji, takich jak pierwiastki i związki, ponieważ mieszaniny zawierają różne substancje, które są łączone fizycznie, ale nie chemicznie. Poszczególne elementy w mieszance zachowują swoją tożsamość.
Mieszanki są dwóch rodzajów: jednorodne i heterogeniczne. Homogeniczna mieszanka ma jednolity skład i wygląd. Poszczególnych substancji, które stanowią jednorodną mieszaninę. Z drugiej strony heterogeniczna mieszanina zawiera dwie lub więcej substancji, które można wyraźnie zaobserwować, a nawet stosunkowo łatwo rozdzielić.
Wykres porównania
Różnice - podobieństwa -| Heterogeniczny | Jednorodny | |
|---|---|---|
| Mundur | NIE | Tak |
| Możesz zobaczyć części | Tak | NIE |
| Można oddzielić fizycznie | Tak | NIE |
| Przykłady | Sałatka, mieszanka szlaków | Oliwa, stal, sól w wodzie |
| Związane chemicznie | NIE | NIE |
Charakterystyka fizyczna
Wszystkie mieszaniny obejmują dwie lub więcej czystej substancji (pierwiastki lub związki). Różnica między mieszaniną a związkiem polega na tym, jak elementy lub substancje łączą się, aby je tworzyć. Związki to czyste substancje, ponieważ zawierają tylko jeden rodzaj cząsteczki. Cząsteczki są wykonane z atomów, które związały się ze sobą. Ale w mieszaninie pierwiastki i związki znajdują się mieszane fizycznie ale nie chemicznie-Żadne wiązania atomowe między czystymi substancjami, które stanowią mieszaninę.
Ale niezależnie od wiązań atomowych, mieszaniny mogą stać się dość spójne. Powszechnie nazywane rozwiązania, Mieszanki jednorodne to te, w których substancje tak dobrze mieszają. Ich kompozycja jest jednolita i.mi., To samo w całej mieszance. Ta jednorodność wynika z tego, że składniki jednorodnej mieszaniny występują w tej samej proporcji w każdej części mieszanki.
Odwrotnie heterogeniczną mieszaniną to taka, w której substancje składowe nie są równomiernie rozmieszczone. Często można je wizualnie opowiadać, a nawet stosunkowo łatwo oddzielić, chociaż istnieje wiele metod oddzielenia również jednorodnych rozwiązań.
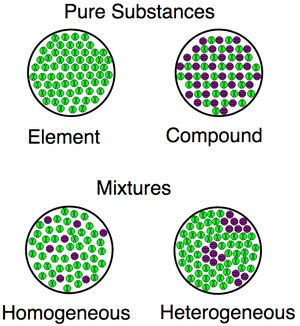 Wizualizacja różnic między substancjami (związkami, pierwiastkami) i mieszaninami (zarówno jednorodnymi, jak i heterogenicznymi).
Wizualizacja różnic między substancjami (związkami, pierwiastkami) i mieszaninami (zarówno jednorodnymi, jak i heterogenicznymi). Przykłady jednorodnych i heterogenicznych mieszanin
Przykładami heterogenicznych mieszanin byłyby kostki lodu (przed stopieniem) w sodzie, płatki w mleku, różne dodatki na pizzy, dodatki w mrożonym jogurcie, pudełko różnych orzechów. Nawet mieszanka oleju i wody jest heterogeniczna, ponieważ gęstość wody i oleju jest inna, co zapobiega jednolitemu rozkładowi w mieszaninie.
Przykładami jednorodnych mieszanin są koktajle mleczne, mieszany sok warzywny, cukier rozpuszczony w kawie, alkohol w wodzie i stopy takie jak stal. Nawet powietrze w naszej atmosferze jest jednorodną mieszanką różnych gazów i zależnych od miasta, które żyjesz. Wiele substancji, takich jak sól i cukier, rozpuszcza się w wodzie, tworząc jednorodne mieszanki.
Rodzaje mieszanin
Istnieją trzy rodziny mieszanin: rozwiązania, zawiesiny i koloidy. Rozwiązania są jednorodne, podczas gdy zawiesiny i koloidy są niejednorodne.
Rozwiązanie
Rozwiązania to jednorodne mieszaniny zawierające substancję rozpuszczoną w rozpuszczalniku, e.G. Sól rozpuszczona w wodzie. Gdy rozpuszczalnik jest wodą, nazywa się go roztworem wodnym. Stosunek masy substancji rozpuszczalnika do rozpuszczalnika nazywa się stężeniem roztworu.
Roztwory mogą być ciekłe, gazowe, a nawet stałe. Co więcej, poszczególne elementy rozwiązania mogą być różnymi stanami materii. Substancja substancji rozpuszczonej (stała, ciekła lub gazowa) rozpuszczalnika, gdy rozpuszczalnik jest większą częścią mieszaniny.
- Roztwory gazowe: Gdy rozpuszczalnik jest gazem, możliwe jest tylko rozpuszczenie w nim gazowych substancji rozpuszczonych. Najczęstszym przykładem roztworu gazowego jest powietrze w naszej atmosferze, którym jest azot (rozpuszczalnik) i ma substancje rozpuszczone takie jak tlen i inne gazy.
- Roztwory ciekłe: Rozpuszczalniki ciekłe są w stanie rozwiązać dowolny rodzaj substancji rozpuszczonych.
- Gaz w cieczy: Przykłady obejmują tlen w wodzie lub dwutlenek węgla w wodzie.
- Płyn w płynie: Przykład obejmuje napoje alkoholowe; są rozwiązaniami etanolu w wodzie.
- Stałe w cieczy: roztwory cukru lub soli w wodzie są przykładami takich mieszanin. Wiele stałych w płynnych mieszaninach nie jest jednorodnych, więc nie są rozwiązaniami. Mogą to być koloidy lub zawiesiny.
- Roztwory stałe: rozpuszczalniki stałe mogą również rozpuścić substancje rozpuszczone w dowolnym stanie materii.
- Gaz w stałym: Przykładem tego jest rozpuszczony wodór w palladie
- Ciecz w stałym: Przykłady tego obejmują rtęć w złoto, tworząc amalgamat i wodę (wilgoć) w soli
- Solidne w stałym: stopy takie jak stal, mosiądz lub brąz są przykładem takich mieszanin.
Zawieszenie
Zawieszenie to heterogeniczna mieszanina, która zawiera cząstki stałe, które są wystarczająco duże do sedymentacji. Cząstki stałe nie rozpuszczają się w rozpuszczalniku, ale są zawieszone i swobodnie pływają. Są większe niż 1 mikrometr i są zwykle wystarczająco duże, aby były widoczne dla nagiego oka. Przykładem jest piasek w wodzie. Kluczową cechą zawiesin jest to, że zawieszone cząsteczki osiedlają się z czasem, jeśli pozostaną niezakłócone.
Koloid
Koloidy są heterogeniczne jak zawiesiny, ale wizualnie wydają się jednorodne, ponieważ cząstki w mieszaninie są bardzo małe 1 nanometr do 1 mikrometru. Różnica między koloidami a zawiesinami polega na tym, że cząstki w koloidach są mniejsze i że cząstki nie będą się z czasem osiedlić.
| Rozwiązanie | Koloid | Zawieszenie | |
|---|---|---|---|
| Jednorodność | Jednorodny | Heterogeniczne na poziomie mikroskopowym, ale wizualnie jednorodne | Heterogeniczny |
| Rozmiar cząsteczki | < 1 nanometer (nm) | 1 nm - 1 mikrometr (μm) | > 1 μm |
| Fizycznie stabilny | Tak | Tak | Wymaga agentów stabilizujących |
| Wykazuje efekt Tyndall | NIE | Tak | Tak |
| Oddziela od wirowania | NIE | Tak | Tak |
| Oddziela się według dekantacji | NIE | NIE | Tak |
Techniczny szczegół
Do pewnego stopnia można powiedzieć (gdybyś był pedantyczny), że pytanie, czy mieszanka jest jednorodna, czy heterogeniczna, zależy od skali, w której pobierany jest mieszanina.
Jeśli skala pobierania próbek jest w porządku (niewielka), może być tak mała jak pojedyncza cząsteczka. W takim przypadku każda próbka stałaby się heterogeniczna, ponieważ można ją wyraźnie wyznaczyć na taką skalę. Podobnie, jeśli próbka jest całą mieszaniną, możesz uznać ją za wystarczająco homogeniczną.
Aby pozostać praktycznym, używamy tej zasady, aby zdecydować, czy mieszanka jest jednorodna: jeśli właściwość zainteresowania mieszaniny jest taka sama, niezależnie od tego, która próbka jest przyjmowana do zastosowanego badania, mieszanina jest jednorodna.

