Różnica między słabą bazą a silną podstawą
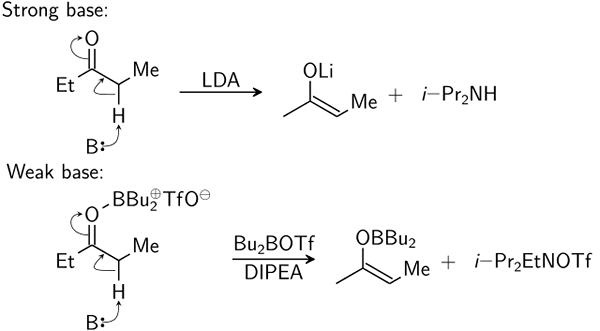
- 933
- 3
- Patrycy Ziółkowski
We współczesnej chemii stosuje się kilka definicji bazy:
- Podstawa Arrheniusa - substancja, która zwiększa stężenie anionów wodorotlenku po rozpuszczeniu w wodzie;
- Podstawa Brønsteda -Lowry'ego - substancja, która zajmuje proton podczas reakcji z kwasem;
- Lewis Base - substancja, która daje parę elektronów innej substancji, podczas reakcji z kwasem.
Najczęściej stosowana jest definicja Brøndsted-Lowry.
Podstawy w szerokim znaczeniu obejmują trzy grupy substancji:
- Rozpuszczalne w wodzie wodorotlenki metalu: NaOH, CA (OH)2, itp.;
- Tlenki lub wodorotlenki, które mogą reagować z kwasem: Feo, AL (OH)3, itp.;
- Inne związki, które po rozpuszczeniu w wodzie oddziałują z nim i uwalniają jony wodorotlenkowe: NH3, Ch3NH2, itp.
Niektóre z ogólnych właściwości podstaw to:
- Mydlanie lub szczupły dotyk;
- Gorzki smak;
- Przewodność elektryczna;
- Brutalna reakcja z substancjami redukowalnymi lub kwaśnymi; żrące w sprawie organicznej;
- Zamień czerwony papierowy papier.
Co to jest słaba baza?
Słabe zasady tylko częściowo dysocjują, aby podawać jony w roztworze.
Kiedy baza jonizuje, pozostawia OH- jon za pobieraniem jonu wodoru z wody. Rozwiązania słabych podstaw mają wyższe H+ koncentracja niż silne podstawy.
Zasadność roztworu wodnego jest określona przez pH.
ph = -log10 [H+]
PH podstaw jest wyższe niż 7.3. Słabe są warunkowo uważane za podstawy z pH poniżej 10.
Ponieważ podstawy są akceptorami protonów, baza otrzymuje OH- jon z wody. Słabe zasady są mniej całkowicie protonowane niż silniejsze zasady, a zatem mają wyższy H+ Stężenie w roztworze. Wyższy h+ Stężenie powoduje niższe pH.
W roztworze wodnym zasady istnieją w równowadze chemicznej. Pozycja równowagi różni się w zależności od siły podstawy. Im słabsza podstawa, im dalej po lewej stronie jest przesunięte równowagę.
Położenie równowagi mierzy się przez stałą równowagi (KB). Im bardziej równowaga leży po lewej stronie, tym niższa wartość dla stałej. Tak więc słabsze zasady mają niższe stałe równowagi.
Słabe podstawy to słabe elektrolity.
Zdolność roztworu do prowadzenia energii elektrycznej zależy od stężenia jonów. Rozwiązanie słabej bazy ma mniej jonów niż roztwór silnego, a zatem ma niższą przewodność elektryczną.
Przykładami słabych podstaw to:
- Alanine (c3H5O2NH2);
- Etyloamina (c2H5NH2);
- Dimetyloamina (ch3)2NH);
- Metyloamina (rozdz3NH2);
- Glicyna (c2H3O2NH2);
- Trimetyloamina (ch3)3N);
- Hydrazyna (n2H4).

Co to jest silna baza?
Silne zasady w pełni dysocjują, aby podać jony w roztworze. Mają pH od 10 do 14.
Silne podstawy są żrące dla żywych tkanek i mogą powodować poważny wpływ. Wspólnymi przykładami silnych zasad są wodorotlenki metali alkalicznych i alkalicznych.
Bardzo silne zasady mogą deprotonować słabe kwaśne grupy C-H, nawet przy braku wody.
Silne zasady mają wyższą stałą równowagi, w porównaniu do słabszych.
Silne podstawy są wysoce reaktywne. Są dobrymi elektrolitami.
Zdolność roztworu do prowadzenia energii elektrycznej zależy od stężenia jonów. Silna baza ma więcej jonów w roztworze niż słaby, więc ma wyższą przewodność elektryczną.
Przykładami silnych podstaw to:
- Wodorotlenek strontu (SR (OH)2);
- Wodorotlenek baru (BA (OH)2);
- Wodorotlenek wapnia (CA (OH)2);
- Wodorotlenek sodu (NaOH);
- Wodorotlenek cezu (CSOH);
- Wodorotlenek potasu (KOH).
Różnica między słabą bazą a silną podstawą
-
Definicja
Słaba baza: Słaba baza jest taka, która tylko częściowo dysocjuje w celu podawania jonów w roztworze.
Silna podstawa: Silna baza to taka, która w pełni dysocjuje, aby podawać jony w roztworze.
-
Dysocjacja
Słaba baza: Słabe zasady tylko częściowo dysocjują w roztworze.
Silna podstawa: Silne podstawy w pełni dysocjują w roztworze.
-
wartość PH
Słaba baza: Słabe podstawy mają pH 7.3 - 10.
Silna podstawa: Silne podstawy mają pH 10–14.
-
Wartość KB
Słaba baza: Słabe zasady mają niższe stałe równowagi, w porównaniu z silnymi.
Silna podstawa: Silne zasady mają wyższą stałą równowagi, w porównaniu z słabymi.
-
Reaktywność
Słaba baza: Słabe podstawy są mniej reaktywne niż silne.
Silna podstawa: Silne podstawy są wysoce reaktywne.
-
Przewodnictwo elektryczne
Słaba baza: Rozwiązanie słabej podstawy ma niższą przewodność elektryczną niż silna podstawa.
Silna podstawa: Rozwiązanie silnej zasady ma wyższą przewodność elektryczną niż w przypadku słabej podstawy.
-
Przykłady
Słaba baza: Przykładami słabych zasad są metyloamina (CH3NH2), glicyna (c2H3O2NH2), trimetyloamina (CH3)3N), hydrazyna (n2H4) itp.
Silna podstawa: Przykładami silnych zasad są wodorotlenek sodu (NaOH), wodorotlenek cezu (CSOH), wodorotlenek potasu (KOH), wodorotlenek barowy (BA (OH)2) itp.
Słaby kontra. Silna podstawa: wykres porównawczy
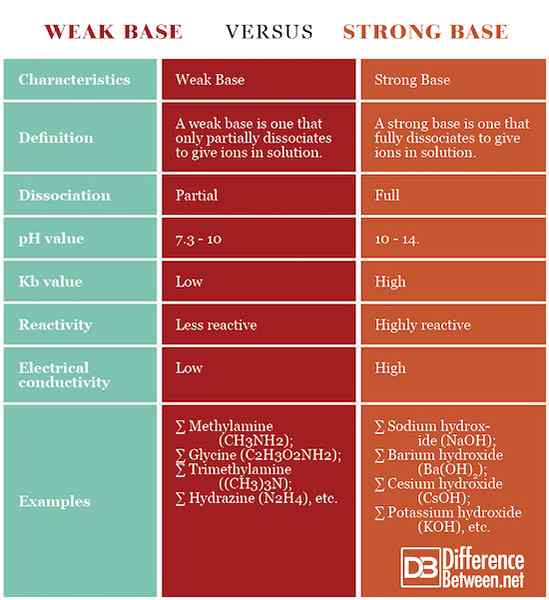
Podsumowanie słabego kontra. Silna baza
- Zgodnie z definicją Brønsteda-Lowry, podstawa jest substancją, która zajmuje proton, gdy reaguje z kwasem.
- Podstawy mają mydło lub szczupły dotyk i gorzki smak. Reagują gwałtownie ze substancjami redukowalnymi lub kwaśnymi i są żrące na materii organicznej.
- Słaba baza jest taka, która tylko częściowo dysocjuje w celu podawania jonów w roztworze.
- Silna baza to taka, która w pełni dysocjuje, aby podawać jony w roztworze.
- Słabe zasady tylko częściowo dysocjują w roztworze, podczas gdy silne zasady w pełni dysocjują w roztworze.
- Słabe podstawy mają pH 7.3 - 10, silne mają pH 10–14.
- Słabe zasady mają niższą stałą równowagi, podczas gdy silne zasady mają wyższą stałą równowagi.
- Silne zasady są wysoce reaktywne, podczas gdy słabe podstawy są mniej reaktywne.
- Rozwiązanie słabej podstawy ma niższą przewodność elektryczną niż silna podstawa.
- Przykładami słabych zasad są metyloamina (CH3NH2), glicyna (c2H3O2NH2), trimetyloamina (CH3)3N), hydrazyna (n2H4) itp. Przykładami silnych zasad są wodorotlenek sodu (NaOH), wodorotlenek baru (BA (OH)2), wodorotlenek cezu (CSOH), wodorotlenek potasu (KOH) itp.

