Różnica między silnym i słabym kwasem
- 2840
- 47
- Pelagia Radomski
Kwasy to substancje chemiczne, które przekazują jony lub protony wodoru po zmieszaniu roztworów. Liczba protonów wydanych przez określony kwas faktycznie określa wytrzymałość kwasu - niezależnie od tego, czy jest to silny kwas, czy słaby kwas. Aby zrozumieć siłę kwasów, trzeba porównać ich tendencję do przekazywania protonów na podobną zasadę (głównie wodę). Siła jest oznaczona liczbą o nazwie PKA.

Co to jest silny kwas?
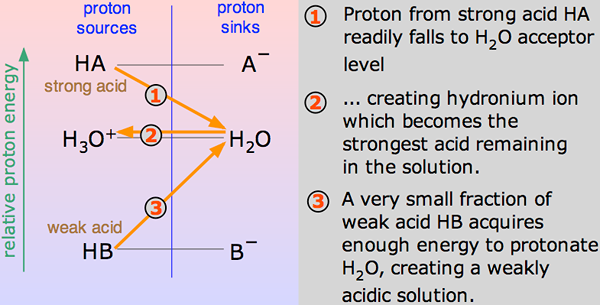
Mówi się, że kwas jest silny, jeśli dysocjuje lub jonizuje całkowicie w roztworze. Oznacza to, że jest w stanie dać największą liczbę jonów H+ lub protony po zmieszaniu w roztworze. Te jony są naładowanymi cząsteczkami. Ponieważ silny kwas przekazuje większą liczbę jonów, gdy się rozkłada lub jonizuje, oznacza to, że silny kwas jest przewodnikiem energii elektrycznej.
Kiedy kwas miesza się w h2O, proton (h+ jon) jest przenoszony do h2O Cząsteczka do wygenerowania H3O+ (Jon hydroksoniowy) i jon a -jonowy na początku kwasu na początek.
W ogólnym scenariuszu,
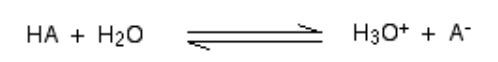
Takie reakcje chemiczne mogą być czczone, ale w kilku przypadkach kwas jest rozdawany h+ jon dość łatwo, a reakcja wygląda jak w jedną stronę. A kwas jest kompletny zdysocjowany.
Za e.G., Gdy chlorek wodoru rozpuszcza się w H2O Aby zrobić HCL, tak niewiele reakcji odwrotnej zdarza się, że możemy napisać:

Pewnego razu nastąpi stu procent reakcji wirtualnej, w której chlorek wodoru będzie wykazywać reakcję z H3O+ (Jon hydroksoniowy) i cl- jony. Tutaj silnym kwasem jest chlorek wodoru.
Co to jest słaby kwas?
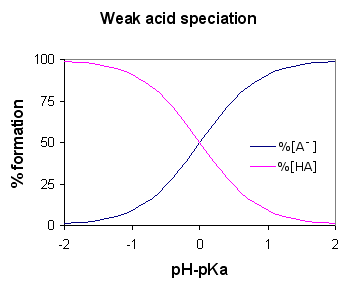
Mówi się, że kwas jest słaby, jeśli jonizuje częściowo lub niekompletnie, wydzielając tylko niektóre z jego atomów wodoru w roztworze. Stąd jest mniej zdolny w porównaniu z silnym kwasem w wydzielaniu protonów. Słabe kwasy mają wyższe PKA niż silne kwasy.
Kwas etanowy jest dobrym przykładem słabego kwasu. Pokazuje reakcję z H2O do produkcji H3O+ (Jony wodne) i CH3COOH (jony etanoanowe), ale reakcja odwrotna wykazuje większy sukces niż do przodu. Cząsteczki reagują dość łatwo, aby poprawić kwas i h2O.

W dowolnym momencie tylko około jeden procent CH3Cząsteczki kwasu COOH wykazują konwersję na jony. Cokolwiek pozostało, to proste cząsteczki kwasu octowego (systematycznie nazywane kwasem etanowym).
Różnica między silnym kwasem a słabym kwasem
-
Definicja
Silny kwas
Silny kwas to kwas, który jonizuje całkowicie w wodnym roztworze. Silny kwas zawsze straci proton (H+), gdy rozpuści się w H2O. Innymi słowy, silny kwas jest zawsze na palcach i dość wydajny w wygłaszaniu protonów.
Słaby kwas
Słaby kwas to taki, który częściowo jonizuje roztworem. Daje tylko kilka swoich atomów wodoru w roztworze. Stąd jest mniej zdolny niż silny kwas.
-
Przewodnictwo elektryczne
Silny kwas
Silne kwasy zawsze będą wykazywać silną przewodność. Silne kwasy zwykle przechodzą więcej prądu w porównaniu ze słabymi kwasami dla tego samego napięcia i stężenia.
Słaby kwas
Słabe kwasy mają niską przewodność. Są słabymi przewodnikami i wykazują niską wartość dla obecnego przejścia
-
Ocena reakcji
Silny kwas
Szybkość reakcji jest szybsza w silnych kwasach
Słaby kwas
Szybkość reakcji jest wolniejsza w słabych kwasach
-
Przykłady
Silny kwas
Kwas chlorowodorowy (HCL), kwas azotowy (HNO3), Kwas nadchlorowy (HCLO4), Kwas siarkowy (h2WIĘC4), Kwas wodny (HI), kwas hydrobomowy (HBR), kwas chlorowy (HCLO3).
Słaby kwas
Kwas siarkowy (h2WIĘC3), Kwas octowy (CH3COOH), kwas fosforowy (h3PO4), Kwas benzoesowy (c6H5COOH), kwas hydrofluorowy (HF), kwas mrówkowy (HCOOH), kwas azotu (HNO2).
-
Ph
Silny kwas
W silnym kwasie pH jest niższe niż, ogólnie 3. Silne kwasy mają bardzo wysokie stężenie jonów H+ (kwas o pH 3 ma 0.001 moli na litr jonów wodoru).
Słaby kwas
Słaby kwas ma pH od 3-7.
-
Wartość PKA
Silny kwas
W silnym kwasie wartość PKA jest dość niska.
Słaby kwas
W słabym kwasie wartość PKA jest dość wysoka.
-
Dysocjacja
Silny kwas
HCl (G)+H2O (L) ≈ H3O+(aq)+cl-(aq)
Słaby kwas
Ch3COOH (L)+H2O (L) ≈ H3O+(aq)+ch3GRUCHAĆ-(aq)
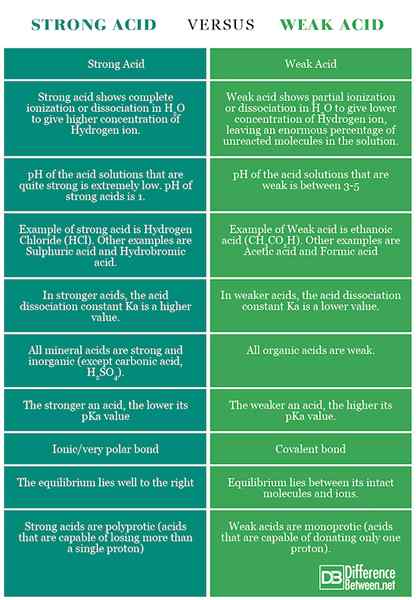
Podsumowanie silnego kwasu vs. Słaby kwas
Punkty różnicy między silnymi i słabymi kwasami zostały podsumowane poniżej: wykres porównawczy
- « Różnica między ciepłem właściwym a pojemnością cieplną
- Różnica między mężczyznami i kobietami golfowymi »

