Różnica między masą molową a masą cząsteczkową
- 902
- 210
- Pelagia Radomski
Chemicy często mierzą substancje za pomocą masy molowej i masy cząsteczkowej. Przykładem jest określenie liczby cząsteczek w cylindrze. Chemia bada interakcję atomów i cząsteczek w skali atomowej.

Jaka jest masa cząsteczkowa?
Po pierwsze, cząsteczka odnosi się do składu podobnych lub różnych atomów ułożonych w stosunku. Cząsteczki mogą tworzyć związki chemiczne podlegające właściwościom fizycznym i chemicznym każdej cząsteczki.
W skrócie masę cząsteczkową odnosi się do całkowitej masy substancji. Podsumowuje średnie masy poszczególnych atomów w cząsteczce tej konkretnej substancji.
Aby określić masę cząsteczkową związku X, musisz dodać masy atomowe wszystkich elementów w składzie, w tym ich mnożenie zgodnie z indeksami indeksu.
Zilustrujemy z przykładem poniżej. Te masy atomowe są pobierane bezpośrednio z okresowej tabeli pierwiastków. Są mierzone w jednostkach masy atomowej (AMU), podobnie jak masa cząsteczkowa.
Przykład 1:
Określ masę cząsteczkową H2O i CH3CH2OH.
Odpowiedź:
Musisz ocenić skład podanych wzorów molekularnych i wyprowadzić ich masy atomowe z okresowej tabeli. Weź pod uwagę indeksywa.
Na przykład H2O wskazuje, że istnieją dwa atomy wodoru i jeden atom tlenu. Masa atomowa wodoru pochodzi z okresu okresowego 1.0079 AMU i tlen wynosi 15.9994. Masa cząsteczkowa związku wynosi 2 (1.0079) + 15.9994 = 18.0152 AMU.
I aby określić masę cząsteczkową etanolu, drugi wzór podany w pytaniu, wykonujemy te same kroki. Istnieją 2 atomy węgla, 6 atomów wodoru i 1 atom tlenu. Masa atomowa atomu węgla wynosi 12.011 AMU. To powiedziawszy, masa cząsteczkowa CH3CH2OH wynosi 2 (12.011) + 6 (1.0079) + 1 (15.9994) = 46.069 AMU. W przypadku ćwiczeń oblicz wzór molekularny etanu (C2H4) i CO2.
Czym jest masa trzonowa?
Jeśli chodzi o koncepcję masy molowej, jest ona definiowana jako masa w kilogramach lub gramach mola substancji. Zwykle jednostki masy molowej to gram/mol. Mole elementu tlenu ma masę 15.9994 gramów. Zatem masa trzonowa wynosiłaby 15.9994 g/mol. Na przykład dla związku dwutlenku węgla masa molowa definiuje się jako masę 1 mola cząsteczek w tym związku. Numer Avogadro, 6.022 x 1023 jest często stosowany do powiązania liczby atomów, cząsteczek i innych jednostek, że masa molowa jest równa. Na przykład masa molowa H2O byłaby równa masie w gramach na kret 6.022 x 1023 Cząsteczki wody. Jeśli brzmi to zbyt technicznie, zilustrujemy z przykładem poniżej:
Przykład 2:
Określ masę molową etanolu.
Odpowiedź:
W pierwszym przykładzie ustaliliśmy masę cząsteczkową etanolu (C2H5OH). Nie daj się mylić inną formułą, jak wyżej wymieniona. Właśnie bawiliśmy się ze strukturalnymi aranżacjami formuły etanolu, chociaż stosunek atomów pozostaje taki sam.
Etanol zawiera 6.022 x 1023 molekuły, a masa molowa jest równa masie etanolu, która zawiera te cząsteczki. Stwierdziliśmy, że masa cząsteczkowa etanolu wynosi 46.069 Atomowe jednostki masy w naszym poprzednim przykładzie. Ta sama procedura jest przestrzegana przy obliczaniu masy molowej.
Jeden kret etanolu ma 2 atomy węgla molowe, 6 mole atomów wodoru i jeden kret atomu tlenu. Biorąc masy atomowe z tabeli okresowej, stwierdzamy, że masa trzonowa wynosi 2 (12.011g) + 6 (1.0079g) + 15.9994G, co jest równe 46.069 g/mo. Zwróć uwagę na tę samą wartość, ale różne jednostki.
NB: Masa molowa dowolnej substancji chemicznej odnosi się do masy atomowej lub masy cząsteczkowej w gramach na kret. Wartości są takie same, ale różne jednostki.
Ćwiczenie 2:
Oblicz masę molową fosforanu wapnia (CA3 (PO4) 2). Odpowiedź powinna wynosić 310.177 g/mol.
W odniesieniu do węgla masa trzonowa z naturalnie występującym węglem jest inna niż ten pochodzący od tabeli okresowej należących do izotopu węglowego-12. Oczywiście węgiel zawiera węgiel-12, węgiel-13 i węgiel-14. Ale kret węgla nadal zawiera 6.022 x 1023, ale o różnych stosunkach tych izotopów.
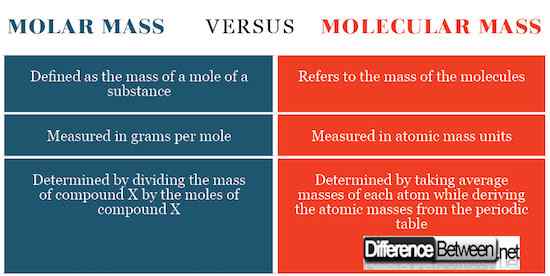
Różnice między masą molową a masą cząsteczkową
Obliczanie masy molowej i masy cząsteczkowej
Masa molowa jest określana przez podzielenie całkowitej masy substancji, która jest średnią masą każdego atomu przez ilość w molach. Powstała liczba będzie gramów na kret lub kilogramy na kret. Masę cząsteczkową jest określana przez obliczenie masy substancji związanej z 1/12 izotopem węgla-12.
Definicja masy molowej i masy cząsteczkowej
Masa cząsteczkowa odnosi się do masy cząsteczek, podczas gdy masa trzonowa odnosi się do masy mola substancji.
Jednostki SI dla masy molowej i masy cząsteczkowej
Masa molowa wyraża się jako gram na mol, podczas gdy masa cząsteczkowa wyraża się jako jednostki masy atomowej. To wyrażenie jednostek SI sięga tego, w jaki sposób te pojęcia są zdefiniowane jako wspomniane.
Podsumowanie masy molowej vs. Masa cząsteczkowa
- Masa molowa i masa cząsteczkowa są ważnymi pojęciami w chemii
- Masa molowa ulega ekspresji w gramach na mol lub kilogramy na mol, podczas gdy masa cząsteczkowa jest wyrażana w masie atomowej. Masa molowa jest zasadniczo bezkładna.
- Obliczamy masę molową, dzieląc masę substancji przez ilość i obliczamy masę cząsteczkową, przyjmując średnią masę jednostek substancji
- Mają te same wartości, ale różne jednostki SI.

