Różnica między wiązaniem jonowym i kowalencyjnym
- 3350
- 905
- Patrycy Ziółkowski
 Wiązanie jonowe vs kowalencyjne
Wiązanie jonowe vs kowalencyjne
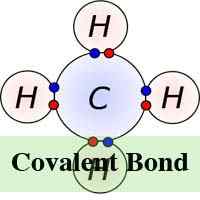
W chemii cząsteczka i związek powstaje, gdy dwa lub więcej atomów łączy się ze sobą w procesie chemicznym znanym jako wiązanie. Istnieją dwa rodzaje wiązań chemicznych „kowalencyjne i jonowe. W jonowej formie wiązania chemicznego atomy, które są połączone ze sobą, robią to poprzez przyciąganie jonów, które mają przeciwny ładunek, a liczba elektronów wymienianych w trakcie procesu może się różnić. Jednak w wiązaniu chemicznym atomy dzielą elektrony.
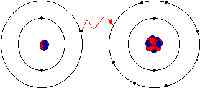
W wiązaniu jonowym elektrony są całkowicie przenoszone z jednego z atomów wiązania z drugim. To siły elektrostatyczne sprawiają, że jony z przeciwnym ładunkiem są przyciągane do siebie. Na przykład w wiązaniu jonowym między sodem a chlorem sód traci jedyny elektron, który jest dodatnio naładowany u ujemnie naładowanego jonu chloru. W wiązaniu jonowym atom tracący elektron kurczy się, a elektrony zyskujące atom rośnie. To nie jest tak w kowalencyjnym wiązaniu, w którym jony są równo udostępniane. Wiązanie kowalencyjne ma miejsce, gdy atomy występują, ponieważ atomy w związku mają podobną zdolność do zdobywania i utraty jonów. Tak więc wiązania jonowe mogą tworzyć się między metali i niemetale, podczas gdy wiązania kowalencyjne tworzą się między dwoma niemetalami.
 Wiązania jonowe można również rozpuszczać w wodzie i innych rodzajach rozpuszczalników polarnych. Również związki jonowe są bardzo dobrymi przewodami energii elektrycznej. Wiązania jonowe prowadzą również do tworzenia krystalicznych ciał stałych o wysokiej temperaturze topnienia. Związki jonowe są również zawsze ciałami stałymi.
Wiązania jonowe można również rozpuszczać w wodzie i innych rodzajach rozpuszczalników polarnych. Również związki jonowe są bardzo dobrymi przewodami energii elektrycznej. Wiązania jonowe prowadzą również do tworzenia krystalicznych ciał stałych o wysokiej temperaturze topnienia. Związki jonowe są również zawsze ciałami stałymi.
Tymczasem, w przeciwieństwie do wiązania jonowego, wiązanie kowalencyjne wymaga istnienia cząsteczek w ich prawdziwej postaci, a zatem cząsteczki kowalencyjne nie są do siebie przyciągane, ale istnieją swobodnie w cieczach lub gazach w temperaturze pokojowej. Kowalencyjne wiązanie może również prowadzić do wielokrotnego wiązania w przeciwieństwie do wiązania jonowego. Wynika to z faktu, że niektóre atomy mają możliwość dzielenia się wieloma parami elektronów, tworząc w ten sposób wiele wiązań kowalencyjnych jednocześnie.

