Różnica między wiązaniami wodorowymi a wiązaniami kowalencyjnymi
- 2730
- 445
- Patrycy Ziółkowski

Temat wyjaśnia, że artykuł opiera się na niektórych pojęciach z chemii. Dla tych, którzy znają podstawowe pojęcia wiązania chemicznego, łatwo jest zrozumieć, że dyskusja dotyczy dwóch rodzajów obligacji. Co do innych, powiedzmy tylko, że wśród wielu wiązań chemicznych, które występują między atomami i cząsteczkami, omówimy i rozróżnimy dwa bardzo ważne rodzaje wiązań, mianowicie wiązań wodorowych i wiązań kowalencyjnych.
Bardzo często ludzie mylą te dwa. Wynika to z niejasnej definicji, która ma wyjaśnić te w stosunku do innych rodzajów wiązań. Najprostszą oferowaną definicją jest to, że wiązanie między dwoma niemetalami jest zwykle kowalencyjne, podczas gdy wiązanie między metalem a niemetalem jest jonowe. Te definicje są dość uogólnione i istnieje wiele wyjątków, a także sprzeczności. Po pierwsze, należy zauważyć, że wszystkie wiązania między dwoma niemetalami nie należą do kategorii wiązań kowalencyjnych; Istnieją również inne wiązania, z których jednym jest wiązanie wodorowe.
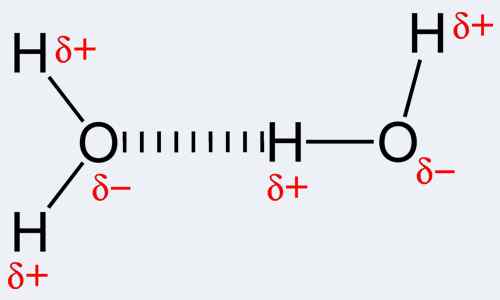
Z definicji wiązanie kowalencyjne jest formą wiązania chemicznego, które występuje z powodu dzielenia par elektronów między tymi samymi lub odrębnymi atomami. Z kolei wiązanie kowalencyjne odnosi się do stabilnej równowagi siły (zarówno atrakcyjnej, jak i odpychającej) między atomami, gdy dzielą elektrony. Udostępnianie pozwala każdemu zaangażowanemu atomowi osiągnąć zewnętrzną powłokę, która jest równoważna z pełną powłoką walencyjną lub zewnętrzną powłoką. To stanowi stabilną konfigurację elektronów. W przeciwieństwie do tego, wiązanie wodorowe to w rzeczywistości nazwa przyciągania elektrostatycznego między specjalnymi typami cząsteczek, znanych jako cząsteczki polarne. Wiązanie wyjątkowo występuje, gdy atom wodoru, który jest już związany z wysoce elektroonegatywnym atomem (jeden z trzech; tlen, azot lub fluor) doświadcza kolejnej siły przyciągania z pobliskiego atomu, który jest również wysoce elektroonegatywny. Zauważ, że wodór musi być tam, aby wiązanie wodorowe wystąpiło, a zatem nazwa wiązania. Ponadto jeden z trzech wyżej wymienionych atomów powinien być z tym związany. Wynika to z faktu, że azot, fluor i tlen są bardzo elektrowni, to znaczy przyciąga do siebie elektrony. To sprawia, że wodór zachowuje się jako dodatnio naładowana cząsteczka, ponieważ ujemnie naładowane elektrony przyciągnęły odpowiednią azot, fluor lub atom tlenu. Dlatego ta cząstka wodoru, która jest obecnie dodatnia, jest łatwo przyciągana w kierunku innego atomu elektroonegatywnego ze względu na jego negatywność. Użycie nazwy wiązania wodorowego do tej interakcji chemicznej jest bardziej jak użycie mylania, ponieważ nie ma prawdziwego wiązania, które powstaje. W efekcie istnieją atrakcje DI-Pole.
Interakcje zachodzące w wiązaniu kowalencyjnym obejmują wiązanie metalu z metalami, trzy środkowe dwa wiązania elektronowe, interakcje agostyczne, wiązanie π i wiązanie σ. Rzeczywiście godne uwagi jest to, że kowalencja jest największa między atomami, które mają podobne elektrowniowości. Oznacza to, że oba atomy nie muszą mieć tego samego elementu, ale powinny mieć porównywalną i bliską elektroonegatywność. W przeciwieństwie do tego wiązania wodorowe są międzycząsteczkowe, to znaczy występują między cząsteczkami lub między różnymi częściami jednej cząsteczki. Wiązania wodorowe są dość silne; silniejsze niż siły van der waals, ale są słabsze niż wiązania kowalencyjne i jonowe. Przykłady cząsteczek, w których występuje wiązanie wodorowe obejmują wodę, a także niektóre cząsteczki organiczne, takie jak białka, DNA itp.
Podsumowanie różnic wyrażonych w punktach
1. Kowalencyjne wiązanie wiązania-wiązanie chemiczne, które występuje z powodu dzielenia par elektronów między tymi samymi lub odrębnymi atomami, wiązanie kowalencyjne odnosi się do stabilnej bilansu siły (zarówno atrakcyjnej, jak i odpychającej) między atomami, gdy dzielą elektrony, dzielenie się każdym atomem na osiągnięcie Zewnętrzna powłoka, która jest równoważna pełnej powładzie walencyjnej lub zewnętrznej skorupy; wiązanie wodorowe jest przyciąganiem elektrostatycznym między specjalnymi typami cząsteczek, znanych jako cząsteczki polarne. Wiązanie jednoznacznie występuje, gdy atom wodoru już wiązał się z wysoce elektroonegatywnym atomem (jeden z trzech; tlen, azot lub fluor) doświadcza kolejnej siły przyciągania z pobliskiego atomu, który jest również wysoce elektroonegatywny
2. Kowalencyjne wiązanie może wystąpić między dużą różnorodnością atomów; wiązania wodorowe wymagają wodoru i jednego tlenu, azotu lub fluoru
3. Wiązanie kowalencyjne są silniejsze niż wiązania wodorowe

