Różnica między energią wiązania a entalpią energii dysocjacji wiązań
- 3299
- 488
- Pelagia Radomski
Energia wiązania vs. Energia dysocjacji wiązań (entalpia)
Energia wiązania jest średnią wartością energii dysocjacji wiązania w fazie gazowej (zwykle w temperaturze 298 k) między tymi samymi typami atomów. Jednak energia energii i dysocjacji wiązań nie są jednak takie same. Energia dysocjacji wiązań jest standardową zmianą entalpii, gdy wiązanie kowalencyjne (określane również jako wiązanie molekularne, jest wiązaniem chemicznym między dwoma niemetalnymi atomami, które obejmuje dzielenie par elektronów między tymi atomami) jest rozszczepione przez homolizę (awaria do równego na równe kawałki), aby dać fragmenty; które zwykle są radykalnymi gatunkami. Stąd główną różnicą między energią wiązania a energią dysocjacji wiązania jest to, że energia wiązania jest średnią wartością, podczas gdy energia dysocjacji wiązania jest szczególną wartością dla konkretnego wiązania.
Co to jest energia energii i dysocjacji wiązań (entalpia)?
Energia wiązania
Energia wiązania odnosi się do energii wymaganej do rozbicia wszystkich wiązań, które istnieją między tym samym 2 typem gatunków chemicznych w związku.
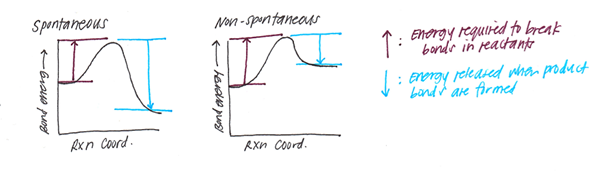
Wykres energii potencjalnej układu 2-atomowego i odległości między gatunkami chemicznymi pokazuje odległość, w której energia jest zbyt mniejsza. Ta ujawniona odległość to długość wiązania między atomami.
Im wyższa energia wiązania (E) związana z określoną parą gatunków chemicznych, tym silniejsze jest wiązanie i mniejsza odległość między 2 atomami.
Energia dysocjacji wiązań
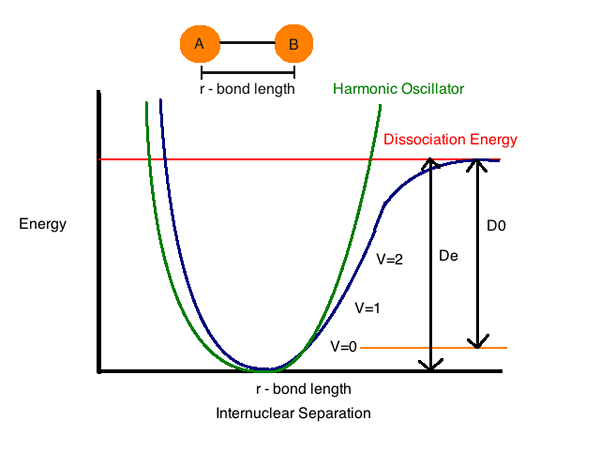
Energia dysocjacji wiązań (entalpia) (H) to ilość energii wymaganej do rozbicia szczególnego wiązania w homolizie. Możemy zdefiniować to jako zmianę entalpii, która ma miejsce, gdy wiązanie ulega dekolcie przez homolizę. Energia dysocjacji wiązań jest specyficzna dla pojedynczego wiązania.
Entalpia wiązań (właściwość termodynamiczna układu) lub energia dysocjacji wiązań jest określana jako standardowa zmiana entalpii, gdy wiązanie jest rozszczepione (oddzielone lub podzielone) przez homolizę (rozkładanie na małe kawałki) z reagentami i produktami reakcji homolizy przy reakcji homolizy przy reakcji homolizy przy reakcji homolizy przy reakcji homolizy przy reakcji homolizy przy reakcji homolizy w reakcji homolizy 0 K (bezwzględne zero).
Różnica między energią energii wiązania i dysocjacji wiązań (entalpia)
Opis
Energia wiązania
Energia wiązania jest również określana jako entalpia wiązania i jest definiowana jako miara siły wiązania w wiązaniu chemicznym. Energia obligacji to średnia wartość
Energia dysocjacji wiązań
Energia dysocjacji wiązań jest zdefiniowana jako standardowa zmiana entalpii, która jest wymagana do złamania wiązania chemicznego
Produkt
Energia wiązania
Energia wiązania oferuje energię potrzebną do utworzenia atomów, które są materiałem początkowym do tworzenia wiązania.
Energia dysocjacji wiązań
Energia dysocjacji wiązań zapewniła energię potrzebną do utworzenia wolnych rodników z atomów, które stworzyły tę konkretną wiązanie.
Przykład
Energia wiązania
W chemii energia wiązania (E) lub entalpia wiązania (H) jest miarą siły wiązania w wiązaniu chemicznym.… Na przykład energia wiązania węgla (C-H) w metanie (CH4) to zmiana entalpii związana z rozbiciem jednej cząsteczki CH4 na atom węglowy (C) i cztery rodniki wodoru (H), podzielone przez cztery.
Energia dysocjacji wiązań
Na przykład w cząsteczce metanu energie dysocjacji wiązań dla wiązań C-H wynoszą 439 kJ/mol, 460 kJ/mol, 423 kJ/mol i 339 kJ/mol. Jednak energia wiązania C-H metanu wynosi 414 kJ/mol, co jest średnią ze wszystkich czterech wartości. Ponadto, dla cząsteczki energia dysocjacji wiązania niekoniecznie musi być równa energii wiązania (jak w przypadku przykładu metanu powyżej). W przypadku cząsteczki dwuatomicznej energii wiązania i energii dysocjacji wiązania są takie same.
Symbol
Energia wiązania
Jest oznaczony przez e
Energia dysocjacji wiązań
Jest oznaczony przez H
Tworzenie obligacji
Energia wiązania
Daje energię potrzebną do utworzenia atomów, które były materiałem początkowym do tworzenia wiązania
Energia dysocjacji wiązań
Daje energię wymaganą do tworzenia wolnych rodników z atomów, które stworzyły tę konkretną wiązanie
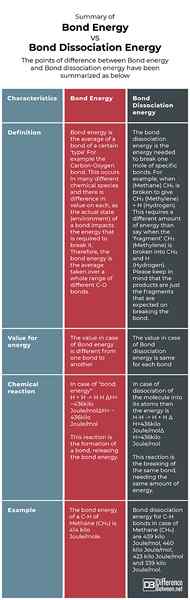
Podsumowanie energii wiązania vs. Energia dysocjacji wiązań
Punkty różnicy między energią wiązania a energią dysocjacji wiązania zostały podsumowane jak poniżej:
- « Różnica między jurysdykcją przedmiotu a jurysdykcją osobistą
- Różnica między zmianami klimatu a zubożeniem ozonu »

