Różnica między adiabatyczną, izotermiczną i izobaryczną
- 3085
- 116
- Spirydion Kruk

Co to jest adiabatyczne?
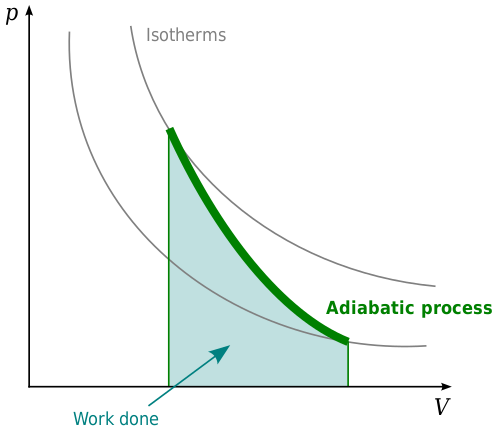
System lub proces adiabatyczny to taki, w którym nie ma zmiany netto energii cieplnej. Procesy adiabatyczne są powiązane z pierwszym prawem termodynamiki. To prawo stwierdza, że gdy energia cieplna zostanie umieszczona w systemie, albo zmieni energię wewnętrzną systemu, albo będzie działać. Jest to związane z prawem ochrony energii, które stwierdza, że materia i energia nie mogą być stworzone ani zniszczone. W kontekście termodynamiki energia cieplna w systemie musi coś zrobić. Albo zmieni energię wewnętrzną systemu, wykona pracę, albo jakaś kombinacja obu. Nie może po prostu zniknąć.
W układzie adiabatycznym ciśnienie, objętość i temperatura zmienią się w taki sposób, że energia cieplna pozostaje stała. Procesy adiabatyczne są najwyraźniej widoczne w gazach. Ogrzewanie adiabatyczne w gazie spowoduje wzrost temperatury wraz ze wzrostem ciśnienia na gaz. Jeśli ciśnienie na gaz, spowoduje to spadek temperatury, co spowoduje chłodzenie adiabatyczne. Przy ogrzewaniu adiabatycznym gaz zostanie skompresowany, a zatem prace będą wykonywane na gazie przez środowisko. Jeśli nastąpi chłodzenie adiabatyczne, spowoduje to rozszerzenie gazu, a gaz będzie działał w środowisku.
Przykładem, w którym procesy adiabatyczne są ważne, jest kontekst tłoka, taki jak tłok w silniku Diesla. Wraz ze wzrostem nacisku na tłok, gaz będzie się kurczył. Z dekompresją gaz rozszerzy się ponownie, przesuwając tłok. Jest to kontrolowane przez procesy adiabatyczne.
Procesy adiabatyczne są ważne w meteorologii. Jeśli paczka powietrza wzrośnie, ciśnienie na działkę spadnie, co spowoduje spadek temperatury powietrza z powodu chłodzenia adiabatycznego. Z drugiej strony, jeśli masa powietrzna zostanie popchnięta na ziemię, spowoduje wzrost ciśnienia na modzie powietrznej, rozgrzewając masy powietrzne. Ponieważ ciśnienie powietrza maleje wraz z wysokością, temperatura spadnie wraz z wysokością w atmosferze. Szybkość, w której temperatura maleje wraz ze wzrostem wysokości, jest znana jako prędkość upływu adiabatycznego.
Co to jest izotermiczne?
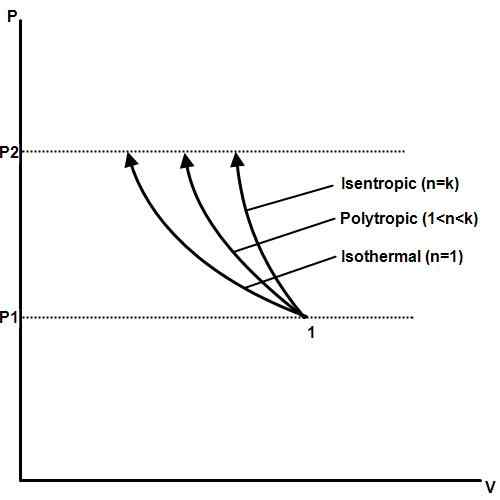
Proces izotermiczny to taki, w którym temperatura pozostaje stała, nawet jeśli ciśnienie i objętość zmieniają się. W termodynamice, ciśnienie, temperatura i objętość są powiązane przez prawo gazowe Boyle. Jeśli ktoś jest utrzymywany na stałym poziomie, pozostałe zmienią się proporcjonalnie do siebie. Jeśli temperatura gazu jest utrzymywana stała, ciśnienie i objętość gazu będą odwrotnie proporcjonalne.
Przykładem procesu izotermicznego jest zmiana fazy. Gdy substancja, taka jak woda, osiągnie swoją temperaturę topnienia lub temperaturę wrzenia, ciśnienie i temperatura pozostaną stałe wraz ze zmianą fazy, objętości i energii cieplnej.
Procesy izotermiczne stanowią podstawę silników cieplnych, które są wykorzystywane w elektrowniach elektrycznych, samochodach, samolotach, rakietach i innych maszynach, które są ważne dla współczesnej cywilizacji. Procesy izotermiczne są również ważne w biologii, geologii, nauk kosmicznych, nauk planetarnych i wielu innych dziedzinach.
Co to jest izobaryczne?
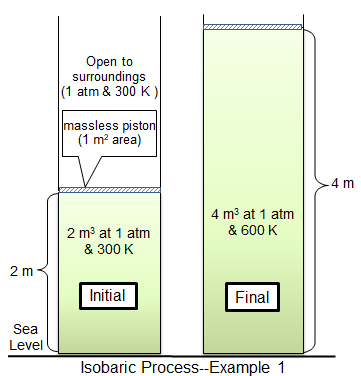
W procesie izobarycznym ciśnienie w układzie pozostaje stałe. W warunkach izobarycznych objętość i temperatura są bezpośrednio powiązane. Jeśli temperatura wzrośnie, musi to objętość. Można to zilustrować, umieszczając balon w zamrażarce. Ciśnienie zarówno wewnątrz balonu, jak i na zewnątrz, pozostanie stałe, ale balon zacznie się kurczyć w objętości, gdy się ostygnie.
Innym przykładem jest tłok ważony, który jest poruszany przez podgrzewany gaz w cylindrze. W miarę ogrzewania gazu temperatura gazu wzrasta, a gaz rozszerza się, pchając tłok. Gdyby tłok został ustalony i nie mógł się poruszać, ciśnienie w gazie wzrosłoby zamiast rozszerzenia gazu, a system nie byłby izobaryczny.
Procesy izobaryczne są ważne w budowie silników cieplnych, ponieważ niektóre silniki cieplne polegają na procesach izobarycznych w celu przekształcenia energii cieplnej w energię mechaniczną.
Podobieństwa między adiabatyczną vs. Izotermal vs. izobaryczne
Procesy adiabatyczne, izotermiczne i izobaryczne są związane z ciśnieniem, temperaturą i objętością. Wszystkie są również najbardziej ilustrowane gazami. Wszystkie trzy rodzaje procesów są również najbardziej istotne w atmosferze planetarnej.
Różnice między adiabatyczną vs. Izotermal vs. izobaryczne
Chociaż procesy te mają podobieństwa, mają również ważne różnice. Obejmują one następujące.
- Temperatura gazu spadnie, gdy gaz rozszerza się w układzie adiabatycznym, podczas gdy temperatura pozostanie stała, gdy gaz rozszerzy się w układzie izotermicznym i wzrośnie, gdy gaz rozszerza się w układzie izobarycznym.
- W systemie adiabatycznym lub izotermicznym objętość gazu jest odwrotnie proporcjonalna do temperatury, podczas gdy jest wprost proporcjonalna do temperatury w układzie izobarycznym.
- Ciśnienie gazu jest odwrotnie proporcjonalne do objętości w układzie izotermicznym, podczas gdy nie zmienia się w układzie izobarycznym, a ciśnienie na gaz jest odwrotnie proporcjonalne do objętości w układzie adiabatycznym.
- Ciepło nie zmienia się w układzie adiabatycznym, podczas gdy zmienia się w systemie izotermicznym lub izobarycznym.
Adiabatic vs. Izotermal vs. izobaryczne

Streszczenie
W systemie adiabatycznym nie ma zmiany netto w cieple. Gdy gaz rozszerzy się, temperatura spadnie, co prowadzi do chłodzenia adiabatycznego. Jeśli gaz zostanie sprężony, temperatura wzrośnie, co prowadzi do ogrzewania adiabatycznego. Procesy adiabatyczne są ważne w naukach atmosferycznych. W procesie izotermicznym temperatura jest stała, a ciśnienie i objętość są odwrotnie powiązane. Przykładem procesu izotermicznego jest zmiana fazy. Podczas zmiany fazy temperatura substancji nie zmieni się, nawet jeśli zmiana ciepła i objętości. W układzie izobarycznym ciśnienie pozostaje stałe, a objętość wzrośnie lub spadnie wraz z temperaturą. Jeśli na przykład objętość gazu zostanie umieszczona w zamrażarce, objętość gazu zmniejszy się, ponieważ ciśnienie jest stałe, podczas gdy jego temperatura spada.

