Obligacje kowalencyjne vs. Wiązania jonowe
- 1086
- 2
- Krystyna Urbanowicz
Istnieją dwa rodzaje wiązań atomowych - wiązania jonowe I wiązania kowalencyjne. Różnią się swoją strukturą i właściwościami. Wiązania kowalencyjne składają się z par elektronów wspólnych przez dwa atomy i wiążą atomy w ustalonej orientacji. Do ich złamania wymagane są stosunkowo wysokie energie (50–200 kcal/mol). To, czy dwa atomy mogą utworzyć kowalencyjne wiązanie, zależy od ich elektroony i.mi. Moc atomu w cząsteczce, aby przyciągnąć elektrony do siebie. Jeśli dwa atomy różnią się znacznie pod względem elektroonegatywności - tak jak sod i chlorek - wówczas jeden z atomów straci elektron z drugim atomem. Powoduje to pozytywnie naładowany jon (kation) i negatywnie naładowany jon (anion). Wiązanie między tymi dwoma jonami nazywa się wiązanie jonowe.
Wykres porównania
| Wiązania kowalencyjne | Wiązania jonowe | |
|---|---|---|
| Co to jest? | Wiązanie kowalencyjne jest formą wiązania chemicznego między dwoma niekomelicznymi atomami, które charakteryzują się dzieleniem par elektronów między atomami i innymi wiązaniami kowalencyjnymi. | Wiązanie jonowe, znane również jako wiązanie elektrowalentne, jest rodzajem wiązania utworzonego z przyciągania elektrostatycznego między przeciwstawnie naładowanymi jonami w związku chemicznym. Tego rodzaju wiązania występują głównie między atomem metali. |
| Tworzenie | Kowalencyjne wiązanie powstaje między dwoma niemetalami, które mają podobne elektroonetywiczność. Żaden atom nie jest wystarczająco „silny”, aby przyciągnąć elektrony od drugiego. W celu stabilizacji dzielą się z innymi elektronami z zewnętrznej orbity molekularnej. | Wiązanie jonowe powstaje między metalem a niemetalem. Niemetale (jon -ve) są „silniejsze” niż metal (+ve jon) i mogą bardzo łatwo uzyskać elektrony z metalu. Te dwa przeciwne jony przyciągają się i tworzą wiązanie jonowe. |
| Występuje między | Dwa nie-metalowe | Jeden metal i jeden nie-metalowy |
| Elektrony | Elektrony są dzielone w kowalencyjnych wiązaniach. | W wiązaniach jonowych elektrony są przenoszone z jednego atomu do drugiego, co powoduje dwa naładowane jony - jeden dodatnio naładowany i jeden ujemnie naładowany. Dwa jony są do siebie przyciągane i tworzą więź jonową. |
| Przykłady | Metan (CH4), kwas hydro -chlorowy (HCl) | Chlorek sodu (NaCl), kwas siarkowy (H2SO4) |
| Temperatura topnienia | Niski | Wysoki |
| Rozpuść się w wodzie? | Różni się | Tak |
| Biegunowość | Niski | Wysoki |
| Kształt | Określony kształt | Brak określonego kształtu |
| Punkt wrzenia | Niski | Wysoki |
| Stan w temperaturze pokojowej | Ciekł lub gazowy | Solidny |
| Konsystencja | Miękki | Kruchy |
O wiązaniach kowalencyjnych i jonowych
Wiązanie kowalencyjne powstaje, gdy dwa atomy są w stanie dzielić elektrony, podczas gdy wiązanie jonowe powstaje, gdy „udostępnianie” jest tak nierówne, że elektron z atomu A jest całkowicie utracony na atom B, co powoduje parę jonów.
Każdy atom składa się z protonów, neutronów i elektronów. W centrum atomu neutrony i protony pozostają razem. Ale elektrony obracają się na orbicie wokół centrum. Każda z tych orbitów molekularnych może mieć pewną liczbę elektronów, tworząc stabilny atom. Ale oprócz gazu obojętnego, ta konfiguracja nie jest obecna w przypadku większości atomów. Aby ustabilizować atom, każdy atom dzieli połowę swoich elektronów.
Wiązanie kowalencyjne jest formą wiązania chemicznego między dwoma niekomelicznymi atomami, które charakteryzują się dzieleniem par elektronów między atomami i innymi wiązaniami kowalencyjnymi. Wiązanie jonowe, znane również jako wiązanie elektrowlencyjne, jest rodzajem wiązania utworzonego z przyciągania elektrostatycznego między przeciwnie naładowanymi jonami w związku chemicznym. Ten rodzaj wiązań występuje głównie między atomem metalicznym i niekometalnym.
Tworzenie i przykłady
Kowalencyjne wiązania powstają w wyniku dzielenia się jednej lub więcej par elektronów wiązania. Elektro negatywność (zdolność przyciągania elektronów) dwóch związanych atomów jest albo równa, albo różnica nie jest większa niż 1.7. Tak długo, jak różnica elektro-ngrzywności nie jest większa niż 1.7, atomy mogą dzielić tylko elektrony wiązania.
 Model podwójnych i pojedynczych kowalencyjnych wiązań węgla w pierścieniu benzenowym.
Model podwójnych i pojedynczych kowalencyjnych wiązań węgla w pierścieniu benzenowym. Na przykład rozważmy cząsteczkę metanu I.mi.Ch4. Carbon ma 6 elektronów, a jego konfiguracja elektroniczna to 1S22S22P2, i.mi. ma 4 elektrony na zewnętrznej orbicie. Zgodnie z zasadą oktanową (stwierdza, że atomy mają tendencję do zysku, tracenia lub dzielenia się elektronami, dzięki czemu każdy atom ma pełny zewnętrzny poziom energii, czyli zazwyczaj 8 elektronów.), aby być w stanie stabilnym, potrzebuje 4 więcej elektronów. Tworzy więc kowalencyjne wiązanie z wodorem (1S1), a poprzez dzielenie elektronów z wodorem tworzy metan lub ch4.
Jeżeli różnica elektro-negatywności jest większa niż 1.7 Następnie wyższy atom elektroonegatywnego ma zdolność przyciągania elektronów, która jest wystarczająco duża, aby wymusić przenoszenie elektronów z mniejszego atomu elektroonegatywnego. To powoduje tworzenie wiązań jonowych.
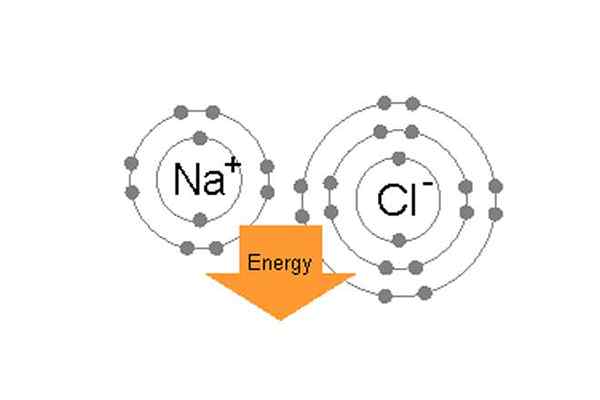
 Wiązanie wiązania sodu i chloru w celu utworzenia chlorku sodu.
Wiązanie wiązania sodu i chloru w celu utworzenia chlorku sodu. Na przykład we wspólnej soli stołowej (NaCl) poszczególnymi atomami są sod i chlor. Chlor ma siedem elektronów walencyjnych na swojej zewnętrznej orbicie, ale aby być w stabilnym stanie, potrzebuje ośmiu elektronów na zewnętrznej orbicie. Z drugiej strony sód ma jeden elektron walencyjny, a także potrzebuje ośmiu elektronów. Ponieważ chlor ma wysoką negocjatywę elektro-negocjat, 3.16 w porównaniu do sodu 0.9, (więc różnica między ich elektro-ngrzywnością wynosi więcej niż 1.7) Chlor może łatwo przyciągnąć jeden elektron walencyjny sodu. W ten sposób tworzą wiązanie jonowe i dzielą się nawzajem elektrony i oba będą miały 8 elektronów w zewnętrznej skorupce.
Charakterystyka wiązań
Kowalencyjne wiązania mają określony i przewidywalny kształt i mają niskie temperatury topnienia i wrzenia. Można je łatwo podzielić na podstawową strukturę, ponieważ atomy są w pobliżu, aby udostępnić elektrony. Są one głównie gazowe, a nawet niewielkie ujemne lub dodatnie ładunek na przeciwnych końcach wiązania kowalencyjnego daje im polarność molekularną.
Wiązania jonowe zwykle tworzą krystaliczne związki i mają wyższe temperatury topnienia i temperatury wrzenia w porównaniu z związkami kowalencyjnymi. Prowadzą one energię elektryczną w stanie stopionego lub roztworu i są wyjątkowo polarnymi wiązaniami. Większość z nich jest rozpuszczalna w wodzie, ale nierozpuszczalna w rozpuszczalnikach niepolarnych. Wymagają znacznie więcej energii niż kowalencyjna wiązanie, aby złamać wiązanie między nimi.
Przyczyną różnicy w punktach topnienia i wrzenia wiązań jonowych i kowalencyjnych jest to, że ilość energii wymaganej do zakłócenia sił międzycząsteczkowych między cząsteczkami utworzonymi przez wiązania kowalencyjne jest znacznie mniejsze niż energia wymagana do zerwania wiązań jonowych w składzie jonowym krystalicznym jonowym złożonym złożonym.

