Butane vs. Metan

- 2833
- 302
- Emilia Rudziński
Butan I metan są węglowodorami z tych samych chemicznych związków rodzinnych znanych jako alkan. Są składnikami gazu ziemnego i ekstrakcją ropy naftowej.
Wykres porównania
Różnice - podobieństwa -| Butan | Metan | |
|---|---|---|
| numer CAS | 106-97-8 y | 74-82-8 y |
| Pubchem | 7843 | 297 |
| Chemspider | 7555 | 291 |
| Uśmiechy | CCCC | C |
| Inchi | 1/C4H10/C1-3-4-2/H3-4H2,1-2H3 | 1/CH4/H1H4 |
| Formuła molekularna | C4H10 | CH4 |
| Masa cząsteczkowa | 58.12 g mol - 1 | 16.042 g/mol |
| Wygląd | Bezbarwny gaz | Bezbarwny gaz |
| Gęstość | 2.48 kg/m3, gaz (15 ° C, 1 atm) 600 kg/m3, ciecz (0 ° C, 1 atm) | 0.717 kg/m3, ciecz gazowy 415 kg/m3 |
| Temperatura topnienia | −138.4 ° C (135.4 K) | -182.5 ° C, 91 K, -297 ° F |
| Punkt wrzenia | −0.5 ° C (272.6 K) | -161.6 ° C, 112 K, -259 ° F |
| Rozpuszczalność w wodzie | 6.1 mg/100 ml (20 ° C) | 35 mg/l (17 ° C) |
| MSDS | Zewnętrzne MSDS | Zewnętrzne MSDS |
| NFPA 704 | 4 1 0 | 4 1 0 |
| Punkt flash | -60 ° C | -188 ° C |
| Wybuchowe limity | 1.8 - 8.4% | 5 - 15% |
| Powiązane alkany | Propan; Pentane | Etan, propan |
| Związki pokrewne | Izobutan; Cyklobutan | Metanol, chlorometan, kwas mrówkowy, formaldehyd, silan |
| Struktura i właściwości | n, εr itp. | n, εr itp. |
| Dane termodynamiczne | Zachowanie fazowe stałe, ciekłe, gazowe | Zachowanie fazowe stałe, ciekłe, gazowe |
| Dane spektralne | UV, IR, NMR, MS | UV, IR, NMR, MS |
| Zastosowania | Butan jest używany w chłodnictwie, zapalniaczach papierosów, ogrzewaniu jako LPG lub upłynnionym gazie naftowym. | Metan jest źródłem energii używanym do celów ogrzewania. |
| Szkodliwe efekty | Butan może powodować uduszenie i migotanie komorowe. | Metan jest silnym gazem cieplarnianym. Może tworzyć wybuchowe mieszanki z powietrzem. |
| Źródła | Ropa naftowa, gaz ziemny. | Pola gazu ziemnego, produkcja biogazu, metan atmosferyczny, dodatkowy metan naziemny. |
Wzór chemiczny i struktura molekularna metanu vs butan
Butan jest c4H10 podczas gdy metan ma wzór chemiczny - CH4. Zatem istnieją cztery atomy wodoru w cząsteczce metanu, podczas gdy w cząsteczce butan. Cząsteczka metanu tworzy strukturę czworościenną, podczas gdy butan jest strukturą liniową.
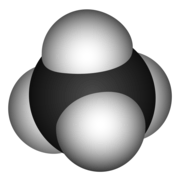 Cząsteczka metanu - renderowanie 3D
Cząsteczka metanu - renderowanie 3D 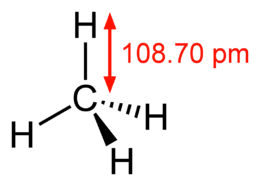 Cząsteczka metanu - wzór strukturalny określony za pomocą spektroskopii mikrofalowej
Cząsteczka metanu - wzór strukturalny określony za pomocą spektroskopii mikrofalowej 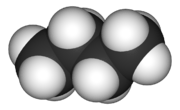 Cząsteczka butanowa - renderowanie 3 -wymiarowe
Cząsteczka butanowa - renderowanie 3 -wymiarowe 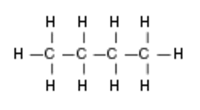 Cząsteczka butanowa - wzór chemiczny
Cząsteczka butanowa - wzór chemiczny Reakcje chemiczne metanu i butanu
Butan reaguje z tlenem, tworząc dwutlenek węgla i pary wodne. W warunkach ograniczonego tlenu butan może tworzyć tlenek węgla lub zwęglony węgiel. Reaguje z chlorem, aby dać chlorobutany i inne pochodne. Metan ulega spalaniu, aby podać formaldehyd, tlenek węgla, a wreszcie dwutlenek węgla i para wodna. Proces jest znany jako piroliza.
Łatwość obsługi
Zarówno metan, jak i butan są gazami bezwonnymi w temperaturach pokoju. Butan można łatwo upłynnić, stąd jest sprzedawany jako paliwo do biwakowania i gotowania. Jest mieszany z propanem i innymi węglowodorami do LPG, który jest komercyjnie używany do ogrzewania i gotowania. Metan jest trudny w transporcie i jest transportowany przez rurociągi i przewoźniki LNG.
W przeciwieństwie do metanu, który jest upartym gazem w normalnym ciśnieniu i temperaturze, butan zamienia się w ciecz po sprężaniu. Ta właściwość przypisuje się słabym centralnym wiązaniom atomu węgla. Gdy tylko ten skropny gaz zetknie się z powietrzem, reaguje z źródłem zapłonu i staje się łatwopalny.
Izomery
Butan wykazuje izomeryzm strukturalny w przeciwieństwie do metanu i ma dwa izomery, n-butan i izo-butan. Metan nie wykazuje izomeryzmu.
Zastosowania metanu vs butan
Butan jest stosowany w dezodorantach, zapalniaczach papierosów, cylindrach gazowych i grzewczych, pędu w aerozolu i czynnika chłodnicze itp. Metan znany również jako bagno lub bagno gazowy jest wykorzystywany do strzelania stacji wytwarzania elektrycznego, samochodów energetycznych itp.
Źródła
Metan występuje w mokradłach i oceanach, atmosferze, ludzkich źródłach, takich jak spalanie paliwa, hodowanie zwierząt gospodarskich, fermentacja materii organicznej itp. Butan można uzyskać jako produkt uboczny podczas ekstrakcji ropy naftowej i jest składnikiem gazu ziemnego.

