Różnica między wysiękiem a dyfuzją
- 5016
- 717
- Pelagia Radomski
Jeśli spojrzysz na okresowy stół elementów, możesz zobaczyć wiele substancji, które składają się na środowisko. To niesamowite wiedzieć, że wszystko składa się z niewielkiej możliwej do zidentyfikowania jednostki zwanej cząsteczkami. Cząsteczki te składają się z atomów, które są utrzymywane przez wiązania chemiczne. Wiązania te są wynikiem wymiany lub dzielenia się elektronów (negatywnie lub dodatnio ładowania cząstek subatomowych) między atomami.
Jeśli chodzi o gazy, ich cząsteczki poruszają się w określony sposób. W 1800 roku kinetyczna teoria molekularna została sformułowana przez dwóch naukowców: James Maxwell i Ludwig Boltzman. Wyjaśnili, jak zachowują się gazy i wyszły z czterema postulatami, które opowiadają o teorii. Oto następujące:
- Cząsteczki gazów są w stałym ruchu, a zderzenie między cząsteczkami gazu a ścianami pojemnika powoduje ciśnienie.
- Cząstki gazu nie oddziałują ze sobą. Nie ma ani odpychającej ani atrakcyjnej siły.
- Temperatura Kelvina jest wprost proporcjonalna do średniej energii kinetycznej.
- Cząstki gazów są tak małe w porównaniu z objętością, którą zajmują, dlatego cząstki uważa się za objętości.
Oprócz tego Thomas Graham, szkocki chemik sformalizował, jak poruszają się gazy. Zatem prawo Graham rządzi zjawiskiem wysięku i dyfuzji. Należy jednak pamiętać, że terminy te są nie tylko ograniczone w chemii, ale są one również szeroko stosowane w wielu naukach, takich jak fizyka i biologia. Jeśli chodzi o chemię, wysięk i dyfuzja to niektóre z zjawisk, które poruszają gazy i ciecze, w których większość ludzi jest mylona z powodu podobnych dźwiękowych nazwisk. Jednak są one zupełnie inne od siebie.
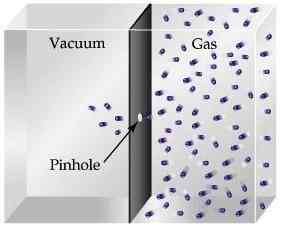
 Wylanie
Wylanie
Wysięk opisany jest jako ruch lub ucieczka cząsteczek gazu przez dziurkę w próżnię.
Opierając się na omówionej powyżej teorii, lżejszy gaz wysiada z większą prędkością w porównaniu z cięższymi, ponieważ cząsteczki zderzają się z otworem, co powoduje, że więcej cząstek ucieknie w czasie jednostki.
Jest to ilościowe przez prawo Grahama - ruch molekularny jest odwrotnie proporcjonalny do pierwiastka kwadratowego masy molowej.
Doskonałym przykładem wysięku jest zjawisko, które występuje z zawyżonymi balonami. Czy kiedykolwiek zauważyłeś, jak balon spada przez pewien czas? Cóż, to dlatego, że powietrze wewnątrz balonu ucieka przez dziurkę lub małą otwór do środowiska.
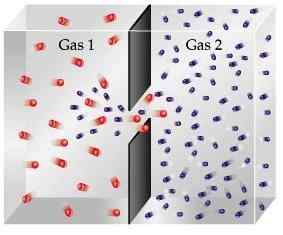 Dyfuzja
Dyfuzja
Dyfuzja pochodzi od łacińskiego słowa „dyfundera”, co oznacza „rozłożenie”. W chemii dyfuzja jest opisywana jako stopniowe mieszanie gazów. Jest to ruch jednego gazu przez drugi przez losowy ruch termiczny powodujący zderzenie się cząsteczek i wymieniając między nimi energię molekularną.
Jest to proces stopniowy, który powoduje, że cząsteczki przechodzą z powierzchni wyższego stężenia do obszaru niższego stężenia. To ciągle występuje i zatrzymuje się tylko wtedy, gdy cząsteczki są równomiernie rozłożone.
Najłatwiejszym sposobem zrozumienia dyfuzji jest otwarcie butelki perfum. Zapach podróżuje i rozprzestrzenia się w otaczające powietrze. Stopniowe mieszanie zapachu z powietrzem obserwuje się, gdy osoba w pobliżu otwartej butelki perfum pachnie najpierw i ostatecznie osoba najdalej od źródła pachnie później. To samo dzieje się, gdy pewna poszczególna pierdzina, szkodliwy zapach rozprasza. Unikaj więc pierdania w miejscach publicznych.
Końcowa myśl!
Dyfuzja i wysięk odgrywają istotną rolę w naszym codziennym życiu. W rzeczywistości dyfuzja jest powszechnym procesem występującym w ciele. Jest to proces między wymianami składników odżywczych, energii i tlenu w naszych systemach. To dość pouczające, aby wiedzieć, jak poruszają się elementy i znać dokładną różnicę między wysiękkiem a dyfuzją.

