Związek vs. Element
- 1326
- 197
- Klarencjusz Rybak
Elementy I Związki to czyste substancje chemiczne występujące w naturze. różnica między elementem a związkiem jest to, że element jest substancją wykonaną z tego samego rodzaju atomów, podczas gdy związek jest wykonany z różnych elementów w określonych proporcjach. Przykłady elementów obejmują żelazo, miedź, wodór i tlen. Przykłady związków obejmują wodę (h2O) i sól (chlorek sodu - NaCl).
Elementy są wymienione zgodnie z ich liczbą atomową w tabeli okresowej. Spośród 117 znanych pierwiastków 94 występuje naturalnie jak węgiel, tlen, wodór itp. 22 są sztucznie wytwarzane, że przeszedł zmiany radioaktywne. Powodem tego jest ich niestabilność, dzięki której ulegają rozpadzie radioaktywnej w okresie, powodując nowe pierwiastki podczas procesu, takie jak uran, toro, bizmut itp. Elementy łączą się w stałych stosunkach i powodują stabilne związki z powodu wiązań chemicznych, które ułatwiają tworzenie związku.
Wykres porównania
| Mieszanina | Element | |
|---|---|---|
| Definicja | Związek zawiera atomy różnych elementów chemicznie połączonych razem w stałym stosunku. | Element jest czystą substancją chemiczną wykonaną z tego samego rodzaju atomu. |
| Kompozycja | Związki zawierają różne pierwiastki w ustalonym stosunku ułożonym w określony sposób przez wiązania chemiczne. Zawierają tylko jeden rodzaj cząsteczki. Elementy, które komponują związek, są chemicznie łączone. | Elementy zawierają tylko jeden rodzaj atomu. Każdy atom ma tę samą liczbę atomową I.mi., Ta sama liczba protonów w ich jądrze. |
| Zdolność do rozbicia | Związek można podzielić na prostsze substancje metodami/reakcjami chemicznymi. | Elementów nie można podzielić na prostsze substancje za pomocą reakcji chemicznych. |
| Reprezentacja | Związek jest reprezentowany przy użyciu jego wzoru chemicznego, który reprezentuje symbole jego elementów składowych i liczbę atomów każdego elementu w jednej cząsteczce związku. | Element jest reprezentowany za pomocą symboli. |
| Typy | Można utworzyć ogromną, praktycznie nieograniczoną liczbę związków chemicznych. Związki są klasyfikowane do związków molekularnych, związków jonowych, związków międzymetalicznych i kompleksów. | Zaobserwowano około 117 elementów. Można klasyfikować jako metal, niemetalowy lub metalowy. |
| Przykłady | Woda (H2O), chlorek sodu (NaCl), wodorowęglan sodu (NaHCO3) i kwas chlorowy (HCL) są przykładami związków. | Wodór (H), tlen (O), sód (Na), chlor (CL), węgiel (C), żelazo (Fe), miedź (Cu), srebro (AG) i złoto (au) są przykładami pierwiastków. |
Różnice w właściwościach
Elementy wyróżniają się swoją nazwą, symbol, liczba atomowa, temperatura topnienia, temperatura wrzenia, gęstość i energie jonizacyjne. W stole okresowej pierwiastki są ułożone zgodnie z ich liczbą atomową i są zgrupowane zgodnie z podobnymi właściwościami chemicznymi i są przedstawione przez ich symbole.
- Liczba atomowa - Liczba atomowa jest oznaczona przez list Z i jest liczbą protonów obecnych w jądrze atomu elementu. Za e.G. węgiel ma 6 protonów w jądrze i dla węgla, z = 6. Liczba protonów wskazuje również na ładunek elektryczny lub liczbę elektronów obecnych w jądrze, który określa właściwości chemiczne elementu.
- Masa atomowa - litera A wskazuje masę atomową elementu, która jest całkowitą liczbą protonów i neutronów w jądrze atomu pierwiastka. Izotopy tych samych elementów różnią się masami atomowymi.
- Izotopy - izotopy elementu mają taką samą liczbę protonów w jądrze, ale różnią się liczbą neutronów. Naturalnie występujące elementy mają więcej niż jeden stabilny izotop. Zatem izotopy mają podobne właściwości chemiczne (z powodu tej samej liczby protonów), ale różne właściwości jądrowe (z powodu różnej liczby neutronów). Za e.G. Węgiel ma trzy izotopy, węgiel - 12, węgiel -13 i węgiel - 14.
- Alotropy - Atomy pierwiastka mogą tworzyć wiązania ze sobą w więcej niż jeden sposób prowadzące do różnicy w ich właściwościach chemicznych. Za e.G. Węgiel wiąże się w czworościanie z tworzeniem diamentu i warstw heksagonów form grafitu.
Związki składają się z różnych elementów w ustalonym proporcji. Na przykład 1 atom sodu (Na) łączy się z 1 atomem chloru (CL), tworząc jedną cząsteczkę związku chlorku sodu (NaCl). Elementy w związku nie zawsze zachowują swoje pierwotne właściwości i nie można ich oddzielić za pomocą środków fizycznych. Łączenie elementów jest ułatwione przez ich wartościowość. Walenda jest definiowana jako liczba wymaganych atomów wodoru, które mogą połączyć się z atomem elementu tworzącym związek. Większość związków może istnieć jako stałe (wystarczająco niskie temperatury) i może być rozkładane przez zastosowanie ciepła. Czasami obce elementy są uwięzione w strukturze krystalicznej związków, nadając im nie jednorodną strukturę. Związki są przedstawione przez ich wzór chemiczny, który podąża za układem wzgórza, w którym najpierw wymieniono atomy węgla, a następnie atomy wodoru, po których elementy są wymienione w kolejności alfabetycznej.
Wizualizacja różnic
Ten obraz pokazuje różnice między pierwiastkami i związkami na poziomie atomowym. Elementy mają tylko 1 rodzaj atomów; Związki mają więcej niż 1. Elementy i związki to zarówno substancje; Różnią się od mieszanin, w których różne substancje mieszają się ze sobą, ale nie poprzez wiązania atomowe.
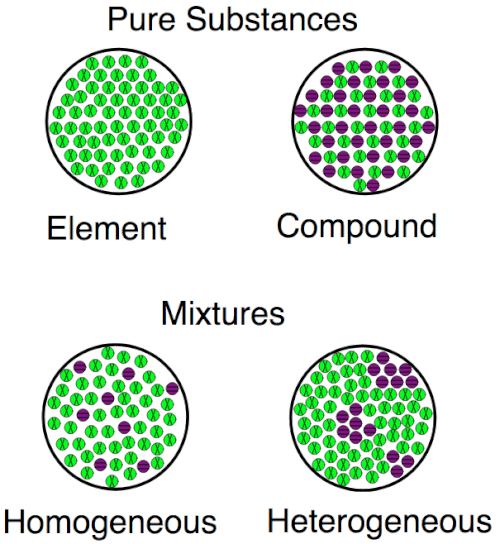 Wizualizacja różnic między pierwiastkami, związkami i mieszaninami, zarówno jednorodnymi, jak i heterogenicznymi.
Wizualizacja różnic między pierwiastkami, związkami i mieszaninami, zarówno jednorodnymi, jak i heterogenicznymi. Historia pierwiastków i związków
Elementy były początkowo używane jako odniesienie do dowolnego stanu materii, takiego jak ciecz, gaz, powietrze, stałe itp. Tradycje indyjskie, japońskie i greckie odnoszą się do pięciu żywiołów, a mianowicie powietrza, wody, ziemi, ognia i eteru. Arystoteles konceptualizował nowy piąty element zwany „kwintessence” - który najwyraźniej utworzył niebo. W miarę kontynuowania badań wielu wybitnych naukowców utorowało drogę do obecnego zrozumienia i opisu elementów. Wśród nich praca Roberta Boyle'a, Antoine Lavoisier, Dmitri Mendelev jest szczególnie godna uwagi. Lavoisier jako pierwszy stworzył listę pierwiastków chemicznych, a Mendeleev jako pierwszy zorganizował pierwiastki zgodnie z ich liczbą atomową w stoliku okresowym. Najbardziej aktualna definicja elementu przyznawana jest badania przeprowadzone przez Henry'ego Moseleya, które stwierdzają, że liczba atomowa atomu jest wyrażana fizycznie przez jego opłatę jądrową.
Przed 1800 rokiem użycie terminu mieszanina może również oznaczać mieszankę. W XIX wieku znaczenie związku można było odróżnić od mieszanki. Alchemicy, tacy jak Joseph Louis Proust, Dalton i Berthollet oraz ich badania dotyczące różnych związków, nadały współczesnej chemii obecna definicja związku. Praca Prousta wykazała światu chemii, że związki stały się stałym składem odpowiednich elementów.
Numer CAS
Każda substancja chemiczna jest identyfikowana przez jego unikalny identyfikator numeryczny - numer CAS (chemikalia streszczenia). Stąd każdy związek chemiczny i element ma liczbę CAS. To sprawia, że baza danych wygodniej wyszukuje elementy i związki.

